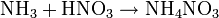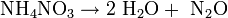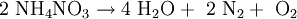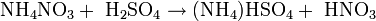- NH4NO3
-
Strukturformel 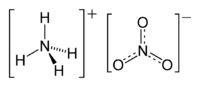
Allgemeines Name Ammoniumnitrat Andere Namen - Ammonsalpeter
- Ammoniaksalpeter
- brennbarer Salpeter
- salpetersaures Ammonium
- Ammonnitrat
- Ammonium nitricum
Summenformel NH4NO3 bzw. H4N2O3 CAS-Nummer 6484-52-2 PubChem 22985 Kurzbeschreibung weißer, pulvriger Feststoff Eigenschaften Molare Masse 80,04 g·mol−1 Aggregatzustand fest
Dichte 1,725 g·cm−3 (20 °C)[1]
Schmelzpunkt Siedepunkt 210 °C (15 mbar), bei Normaldruck Zersetzung ab 170 °C[1]
Dampfdruck nicht anwendbar[2]
Löslichkeit bei 20 °C 1177 g/l in Wasser, löslich in Methanol
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 
Brand-
fördernd(O) R- und S-Sätze R: 8-9 S: 15-16-41 Thermodynamische Eigenschaften ΔHf0 −366 kJ·mol−1[3]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Ammoniumnitrat ist das Salz, das sich aus Ammoniak und Salpetersäure bildet.
Inhaltsverzeichnis
Herstellung
Ammoniumnitrat (NH4NO3) entsteht durch Neutralisation von Ammoniak mit Salpetersäure.
Verwendung
Ammoniumnitrat ist der Hauptbestandteil vieler Düngemittel (Blaukorn, Kalkammonsalpeter, Nitramoncal), gewerblicher Sprengstoffe, beispielsweise der Sprengmittel ANFO und Donarit aber auch in oft illegal hergestellten Sprengstoffen wie ANNM oder GRG-1.
Eigenschaften
Beim Erhitzen (T> 170 °C) zerfällt Ammoniumnitrat gemäß der Gleichung [4]
in Wasser und Lachgas. Durch starke Initialzündung zerfällt es folgendermaßen:
Das Nitrat-Ion NO3− (Oxidationsstufe von N: +V) oxidiert dabei das Ammonium-Ion NH4+, (Oxidationsstufe −III). Im Produkt, N2, sind beide Stickstoffatome auf gleicher Oxidationsstufe (0). Eine solche Reaktion, bei der ein Atom ein anderes Atom desselben Elements oxidiert, heißt Komproportionierung. Der explosionsartige Übergang vom Feststoff (NH4NO3) zu den gasförmigen Produkten Stickstoff, Sauerstoff und Wasserdampf erklärt die hohe Sprengkraft.
Durch Reaktion mit konzentrierter Schwefelsäure und anschließender Destillation lässt sich die Salpetersäure zurückgewinnen, welche die Ausgangssubstanz zur Herstellung vieler Explosivstoffe ist:
Die Chemikalie gilt als brandfördernd und kann beim Erhitzen explodieren. In der Bundesrepublik Deutschland ist der Umgang mit den durchsichtigen und farblosen Kristallen durch das Sprengstoffgesetz geregelt. In Düngemitteln darf Ammoniumnitrat wegen seiner latenten Gefahr nur in Mischungen mit harmlosen Stoffen wie Kalk verwendet werden (KAS27).
Katastrophen
- Eine große Katastrophe war die Explosion des Oppauer Ammoniakwerkes am 21. September 1921. Dort wurde routinemäßig vor dem Versand ein festgewordenes Dünger-Gemisch aus Ammoniumnitrat und Ammoniumsulfat mit Dynamit gelockert. Vermutlich aufgrund eines Fehlers beim Mischungsverhältnis kam es bei einer solchen Explosion zu einer Initialzündung, die dann insgesamt 4500 Tonnen des Gemisches zur Explosion brachte und einen der größten Explosionsschäden der Geschichte verursachte: 561 Menschen kamen ums Leben und ein großer Teil der Fabrik und der umliegenden Bebauung waren zerstört.
- Am 16. April 1947 explodierten im Hafen von Texas City (Texas, USA) die mit Ammoniumnitrat beladenen Frachter Grandcamp (Frankreich) und Highflyer (USA). Es gab 486 Tote, über 100 Vermisste, 3000 Verletzte, Hunderte Obdachlose und 65 Millionen US-Dollar Schaden. [1]
- Am 28. Juli 1947 explodierte im Hafen von Brest (Frankreich) der mit Ammoniumnitrat beladene Frachter Ocean Liberty (Norwegen): 21 Tote, über 100 Verletzte und 2 Millionen Pfund Schaden.
- Bei dem Bombenanschlag auf das Murrah Federal Building in Oklahoma City (USA) am 19. April 1995 verwendete der Attentäter Timothy McVeigh eine Mischung aus Ammoniumnitrat und einem Brennstoff (Nitromethan). Bei dem Anschlag wurde ein neunstöckiges Bürogebäude durch eine Autobombe zerstört, 168 Menschen kamen ums Leben.
- Am 21. September 2001 starben bei einer Ammoniumnitrat-Explosion in Toulouse 31 Menschen.
- Am 22. April 2004 ereignete sich im nordkoreanischen Ryongchŏn eine verheerende Explosion eines mit Ammoniumnitrat beladenen Zugwaggons. Mindestens 161 Menschen starben, nach Schätzungen wurden rund 1300 Menschen verletzt und 8000 Häuser zerstört oder beschädigt. Siehe Zugunglück von Ryongchŏn
Siehe auch
Quellen
- ↑ a b c d Eintrag zu Ammoniumnitrat in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 3.9.2007 (JavaScript erforderlich)
- ↑ Sicherheitsdatenblatt (Merck)
- ↑ PAETEC Formelsammlung Ausgabe 2003, Seite 116
- ↑ Holleman Wiberg, 101 Aufl. S.656
Literatur
- Technische Regel für Gefahrstoffe TRGS 511 - Ammoniumnitrat -, Bundesministerium für Arbeit und Soziales, Ausgabe Juni 2004, http://www.baua.de/nn_16716/de/Themen-von-A-Z/Gefahrstoffe/TRGS/pdf/TRGS-511.pdf
- Richard Escales: Ammonsalpetersprengstoffe. Survival Press, 1909, Reprint 2002, ISBN 3-8311-3563-0
- K. Hahnefeld, R. Gill, G. Buske: Einflussgrößen auf Detonationsfähigkeit von Ammoniumnitrat. Wirtschaftsverlag NW, Bremerhaven 1983, ISBN 3-88314-308-1
Weblinks
Wikimedia Foundation.