- Na2S2O3
-
Strukturformel 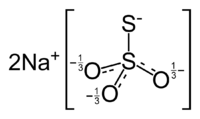
Allgemeines Name Natriumthiosulfat Andere Namen Natriumhyposulfit (veraltet)
Summenformel Na2S2O3 CAS-Nummer - 7772-98-7 (wasserfrei)
- 10102-17-7 (Pentahydrat)
ATC-Code V03AB06
Kurzbeschreibung geruchloses und farbloses Pulver Eigenschaften Molare Masse 158,11 g·mol−1 Aggregatzustand fest
Dichte 1,67 g·cm−3 (20 °C)[1]
Schmelzpunkt Siedepunkt Zersetzung ab 300 °C[1]
Löslichkeit gut in Wasser (701 g·l−1 bei 20 °C)[1], nicht in Ethanol
Sicherheitshinweise Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Natriumthiosulfat ist das stabile Natriumsalz der in freiem Zustand instabilen Thioschwefelsäure.
Inhaltsverzeichnis
Gewinnung und Darstellung
Natriumthiosulfat wird durch Einrühren von Schwefel in kochende Natriumsulfitlösung hergestellt:
Eigenschaften
Natriumthiosulfat bildet farblose Kristalle, die mit 5 Mol Kristallwasser kristallisieren und gut wasserlöslich sind; beim Auflösen kühlt sich die Flüssigkeit stark ab, da die Hydratationsenthalpie kleiner ist als die Gitterenergie und die fehlende Wärmemenge dem System entzogen wird. Dieses so genannte Pentahydrat Na2S2O3 · 5 H2O ist auch unter dem Namen Fixiersalz bekannt, da es bei der Filmentwicklung zur Fixierung dient. Unter dem Namen Antichlor wird es nach dem Bleichen von Papier- und Textilfasern verwendet, um überschüssiges Chlor zu entfernen.
Die Pentahydrat-Kristalle haben einen Schmelzpunkt von 48,5 °C, die Schmelze kann unterkühlt werden und gibt beim durch einen Impfkristall ausgelösten Erstarren eine große Menge von Kristallisationswärme ab. Wird zur wässrigen Natriumthiosulfat-Lösung Säure hinzugefügt, so scheidet sich nach kurzer Zeit Schwefel in Form einer gelblichen Trübung aus. Die freigesetzte, instabile Thioschwefelsäure (H2S2O3) zerfällt nämlich rasch zu Schwefel und Schwefeldioxid:Die wasserunlöslichen Silberhalogenide werden durch eine Fixiersalzlösung aufgelöst. Durch die Bildung des wasserlöslichen Natriumdithiosulfatoargentat(I)-Komplexes wird der entwickelte Film lichtunempfindlich:
Natriumthiosulfat ist ein Reduktionsmittel und reagiert daher leicht mit dem Oxidationsmittel Kaliumpermanganat.
Verwendung
Natriumthiosulfat dient in der Fotografie als Fixiersalz, im Bergbau zur Extraktion von Silberchlorid aus Silbererzen und in der Galvanotechnik zur Herstellung von Gold- und Silberbädern. In der Medizin wird es als Gegenmittel bei Cyanidvergiftungen verwendet, dabei wird weniger gefährliches Thiocyanat gebildet.
Natriumthiosulfat dient auch zur Neutralisation von Chlor im Wasser: zur Bindung von 1 g Chlor werden 2 g Natriumthiosulfat benötigt.
In der Chemie wird es zur Bestimmung der Iodzahl verwendet, in der Iodometrie wird Thiosulfat zu Tetrathionat oxidiert:
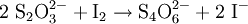 .
.
Weitere Verwendung findet es z. B. in sogenannten Wärmekissen. Durch das Biegen eines Metallplättchens entsteht ein Kristallisationskeim, der eine exotherme Reaktion auslöst. Die Regeneration des Kissens erfolgt durch Erwärmen in kochendem Wasser.
Einzelnachweise
Wikimedia Foundation.

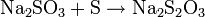

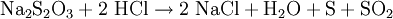
![\mathrm{2\ Na_2S_2O_3 + AgCl \rightarrow Na_3[Ag(S_2O_3)_2] + NaCl}](/pictures/dewiki/55/75cb04aa6337b35483e7fdd4e4f34d79.png)