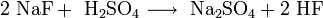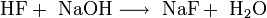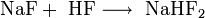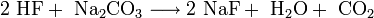- NaF
-
Kristallstruktur 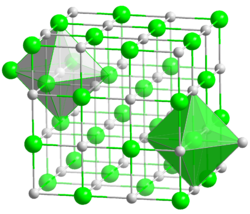
__ Na+ __ F- Kristallsystem kubisch Raumgruppe 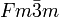
Koordinationszahlen Na[6], F[6] Allgemeines Name Natriumfluorid Andere Namen - Fluornatrium
- Fluorol
Verhältnisformel NaF CAS-Nummer 7681-49-4 ATC-Code Kurzbeschreibung weißer Feststoff Eigenschaften Molare Masse 41,99 g·mol–1 Aggregatzustand fest
Dichte 2,79 g·cm–3[1]
Schmelzpunkt Siedepunkt 1704 °C[1]
Löslichkeit 42,2 g/l in Wasser (20 °C)[1]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 
Giftig (T) R- und S-Sätze R: 25-32-36/38 S: (1/2)-22-36-45 Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln MAK 1 mg/m3[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Natriumfluorid ist ein Natriumsalz der Fluorwasserstoffsäure.
Inhaltsverzeichnis
Eigenschaften
Das farblose Natriumfluorid kristallisiert in der Natriumchloridstruktur und lässt sich zu Einkristallen "züchten". Es ist durchlässig für Infrarot- und UV-Licht. In Wasser ist es bei allen Temperaturen nur mäßig löslich. Erwärmen steigert die Löslichkeit kaum. In Ethanol löst es sich nicht. In konzentrierter Schwefelsäure setzt es sich zu Natriumsulfat und Fluorwasserstoff um. Infolge teilweise stattfindender Hydrolyse reagiert die wässrige Lösung von Natriumfluorid leicht alkalisch. Natriumfluorid wirkt als Insektizid und ist giftig.
Natriumfluorid bildet mit Natriumchlorid, Natriumcarbonat und Calciumfluorid Schmelzen mit einem Eutektikum, mit Natriumsulfat Schmelzen mit zwei Eutektika. Flüssiges Natriumfluorid leitet den elektrischen Strom, wobei der Widerstand mit steigender Temperatur abnimmt.
Reaktionsverhalten
Natriumfluorid und Schwefelsäure reagieren zu Natriumsulfat und Fluorwasserstoff.
Die hohe Toxizität von NaF im Vergleich zu anderen Natriumhalogeniden (z.B. Natriumchlorid) ist in der Wirkung des Fluoridanions als starke Lewis-Base begründet. Das Fluorid bindet an alle eisenhaltigen Enzyme und blockiert sie somit.
Darstellung
Neutralisation von konzentrierter Fluorwasserstoffsäure mit Natronlauge[3]
Überschüssiger Fluorwasserstoff führt zur Bildung von Natriumhydrogenfluorid:
Umsetzung von Fluorwasserstoffsäure mit Natriumcarbonat:
Ausgehend vom Natriumsalz der Hexafluorokieselsäure kann Natriumfluorid durch thermische Zersetzung gewonnen werden.
Verwendung
Natriumfluorid wird als Holzschutzmittel und zum Konservieren von Klebstoffen verwendet. Bei der elektrolytischen Gewinnung von Aluminium dient es als Flussmittel, in der Metallurgie als Schlackenzusatz für Metallschmelzen.
Weitere Anwendungen:- Trübungs- und Flussmittel in der Glasherstellung
- Zur Reinigung anderer Fluoride durch Bindung von überschüssigem Fluorwasserstoff
- Fluorierungsmittel in der Organischen Chemie.
- Einkristalle dienen in der Instrumentellen Analytik als Filter, Linsen und Prismen
- In der Photometrie als Maskierungsmittel für Eisenionen
- Fluoridierung von Trinkwasser, Speisesalz, Zahncreme usw., Fluortabletten
- Reinigung von Uranhexafluorid bei der Wiederaufarbeitung
- Als Phosphataseinhibitor in der Molekularbiologie
Vorsichtsmaßnahmen
Natriumfluorid ist giftig. Das Einatmen von Stäuben ist zu vermeiden. Bei der Arbeit mit Natriumfluorid sind Handschuhe zu tragen. Als letal wird eine Menge von 15 mg/kg Körpergewicht angesehen.[4]
Einzelnachweise
- ↑ a b c d e Eintrag zu Natriumfluorid in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 18.12.2007 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 7681-49-4 im European chemical Substances Information System ESIS
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 235-6.
- ↑ Fluorverbindungen in Mundhygieneprodukten
Wikimedia Foundation.