- Myoglobin
-
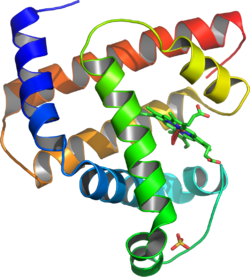
Myoglobin Bändermodell von Myoglobin (α-Helices) mit Häm (Stäbchenmodell). Masse/Länge Primärstruktur 153 Aminosäuren Sekundär- bis Quartärstruktur Monomer Bezeichner Gen-Namen MB; MGC13548; PVALB Externe IDs OMIM: 160000 UniProt: P02144 MGI: 96922 Vorkommen Homologie-Familie Myoglobin Übergeordnetes Taxon Chordatiere Myoglobin ist ein Muskeleiweiß (von griechisch μυς, mys, „der Muskel“ und lateinisch globus, "die Kugel") aus der Gruppe der Globine, kugelförmigen Eiweißen, die eine sauerstoffbindende Hämgruppe enthalten. Myoglobin kann Sauerstoff aufnehmen und wieder abgeben und ist verantwortlich für den intramuskulären Sauerstofftransport. Es übernimmt den Sauerstoff aus dem Blut vom Hämoglobin und gibt ihn am Ort der physiologischen Verbrennungsprozesse in den Muskelzellen wieder ab.
Inhaltsverzeichnis
Wissenschaftliche Beschreibung
Myoglobin ist ein Häm-basiertes, globuläres, einkettiges Protein aus 153 Aminosäuren mit einer Molekülmasse von 17.053 Dalton (17 kDa), das die Fähigkeit besitzt, Sauerstoff reversibel zu binden. Die Sekundärstruktur des Proteins besteht aus insgesamt acht α-Helices.
Unter physiologischen Bedingungen liegt es als Monomer vor. Das aktive Zentrum des Myoglobins ist ein Häm b, d.h. ein Protoporphyrin IX mit einem über die vier inneren Stickstoffe ligierten Eisen(II)-Ion. Das Häm ist über ein axial an das zentrale Eisenion koordiniertes, proximales Histidin an die Proteinmatrix gebunden. Die zweite axiale Position dient der Bindung des Sauerstoffmoleküls.
Im Gegensatz zum strukturverwandten Hämoglobin bindet Myoglobin den Sauerstoff nicht positiv kooperativ, sondern unabhängig von der Sauerstoffkonzentration der Umgebung.
Das Vorkommen von Myoglobin ist auf Herz- und Skelettmuskelzellen von Säugetieren beschränkt. Hier liegt es in hohen Konzentrationen (bis etwa 100 µmol/l) vor und gibt dem Muskelgewebe seine rote Farbe. Die Sauerstoffaufnahme kann gut absorptionsspektroskopisch verfolgt werden, die charakteristische Soret-Bande des Häm verschiebt sich bei Sauerstoffaufnahme deutlich von 418 zu 434 nm.
Myoglobin zählt zu den Globinen. Dem Myoglobin nah verwandt ist das erst 2002 beschriebene Cytoglobin,[1] welches in nahezu allen Zellen der Wirbeltiere vorkommt. Es dient vermutlich ebenso als Sauerstoffspeicher in der Zelle. Es scheint sogar, dass Myoglobin wohl während der Evolution durch eine Genduplikation die muskelspezifische Variante des Cytoglobins geworden ist.
Bedeutung
Als biologische Funktion wird der Sauerstoff-Transport innerhalb der Zelle, von der Zellmembran zu den Mitochondrien, angesehen. Aus diesem Grund ist seine Affinität zum Sauerstoff auch höher als bei Hämoglobin, dies fördert den Sauerstofftransport in Richtung Zellinneres. Auch die beim Hämoglobin beobachtete Regulation der Sauerstoffaffinität fehlt dem Myoglobin. Zumindest bei Meeressäugetieren wird auch die Sauerstoff-Speicherung diskutiert: Wale haben einen etwa 5-10 mal höheren Myoglobin-Gehalt in ihrer Muskulatur als Landsäugetiere.
Das Myoglobin des Pottwals war daher auch das erste Protein, an dem John Kendrew 1958 eine Strukturaufklärung (Röntgenstrukturanalyse) gelang.[2] Diese Pionierleistung war Grundlage für die spätere Aufklärung der Hämoglobin-Struktur durch Max Perutz (1959).[3] Beide Wissenschaftler erhielten 1962 den Nobelpreis für Chemie.
Bedeutung in der Medizin
Ein Anstieg der Myoglobinkonzentration im Blutserum von Säugetieren kann aufgrund von Rhabdomyolyse als Indikator für einen Herzinfarkt gelten. Da ein erhöhter Myoglobinwert aber unspezifisch ist, verwendet man heute die Creatinkinase zur Herzdiagnostik. Weiterhin zeigen sich erhöhte Myoglobinwerte bei Schädigung der Skelettmuskulatur (extremer Sport, epileptische Anfälle, Polytrauma, intramuskuläre Injektionen, Alkoholintoxikation, Muskelerkrankungen, Verschüttungen (z. B. bei Erdbeben)); diese können bei extrem erhöhten Werten zu einem akuten Nierenversagen führen (Crush-Niere).[4][5]
Die Plasmahalbwertszeit von Myoglobin beträgt nur 10 bis 20 min, da es rasch über die Nieren ausgeschieden wird (glomeruläre Filtration). Der Myoglobinwert steigt bei einem Herzinfarkt nach ca. 1–2 Stunden an und erreicht sein Maximum nach 4–6 Stunden. Bereits innerhalb von 12–24 Stunden sinkt es wieder in den Normbereich ab.
Normwerte beim Menschen im Blut:[6] Frauen bis 35 µg/l, Männer bis 55 µg/l
Normwert beim Menschen im Urin: Frauen und Männer bis 0,3 mg/l
Literatur
- Brunori M: Myoglobin strikes back. In: Protein Sci.. 19, Nr. 2, Februar 2010, S. 195–201. doi:10.1002/pro.300. PMID 19953516.
Weblinks
- Hemoglobin-Myoglobin in Englisch.
- Myoglobin
Einzelnachweise
- ↑ Trent JT, Hargrove MS: A ubiquitously expressed human hexacoordinate hemoglobin. In: J. Biol. Chem.. 277, Nr. 22, Mai 2002, S. 19538–45. doi:10.1074/jbc.M201934200. PMID 11893755.
- ↑ KENDREW JC, BODO G, DINTZIS HM, PARRISH RG, WYCKOFF H, PHILLIPS DC: A three-dimensional model of the myoglobin molecule obtained by x-ray analysis. In: Nature. 181, Nr. 4610, März 1958, S. 662–6. doi:10.1038/181662a0. PMID 13517261.
- ↑ : Structure of H. In: Nature. 185, Nr. 4711, 1960, S. 416–422. doi:10.1038/185416a0. PMID 18990801.
- ↑ Stone MJ, Waterman MR, Harimoto D, et al.: Serum myoglobin level as diagnostic test in patients with acute myocardial infarction. In: Br Heart J. 39, Nr. 4, April 1977, S. 375–80. PMID 869974. Volltext bei PMC: 483248.
- ↑ Plotnikov EY, Chupyrkina AA, Pevzner IB, Isaev NK, Zorov DB: Myoglobin causes oxidative stress, increase of NO production and dysfunction of kidney's mitochondria. In: Biochim. Biophys. Acta. 1792, Nr. 8, August 2009, S. 796–803. doi:10.1016/j.bbadis.2009.06.005. PMID 19545623.
- ↑ Laborlexikon: Myoglobin
Wikimedia Foundation.