- Organische Basen
Organische Basen (Alkaloide), in der organischen Chemie eine Klasse von stickstoffhaltigen Verbindungen, welche sich den Säuren gegenüber verhalten wie die Basen der unorganischen Chemie. In Betreff ihrer Constitution glaubte Berzelius, daß das Basische in den O-n B. Ammoniak sei, u. hielt sie für gepaarte Ammoniakverbindungen; Liebig dagegen glaubte, die O-n B. seien Verbindungen eines stickstofffreien Körpers mit Amid (NH2). Die meisten der O-n B. lassen sich nach den neuesten Untersuchungen vom Typus Ammoniak (NH3) od. Ammoniumoxydhydrat (NH4O + HO) ableiten, in denen ein Theil od. aller Wasserstoff durch Basyle (kohlenstoffhaltige Radicale, welche mit Sauerstoff Basen erzeugen) ersetzt ist, u. diese Verbindungen begreift man neuerdings vorzugsweise unter dem Namen der O-n B. Die genaue Kenntniß der Zusammensetzung dieser O-n B. beschränkt sich eigentlich nur auf die, in denen der Wasserstoff durch Alkoholradikale ersetzt ist, weil die meisten künstlich dargestellt werden können. Bei den meisten der sehr zahlreichen, bes. aus dem Pflanzenreiche gewonnenen O-n B. ist die künstliche Darstellung noch nicht gelungen, doch lassen auch sie sich höchst wahrscheinlich als Substitutionen von Ammoniak od. Ammoniumoxydhydrat betrachten. Nach dieser Anschauungsweise ergeben sich folgende Reihen von O-n B., abgeleitet vom Typus Ammoniak
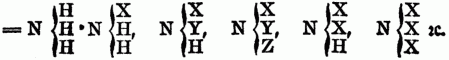
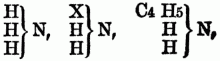
z.B.:
Auch kann in solchen substituirten Ammoniaken wiederum ein od. mehre Äquivalente Wasserstoff durch Chlor, Brom, Untersalpetersäure etc. vertreten werden, so entsteht z.B. aus Phenhlamin =
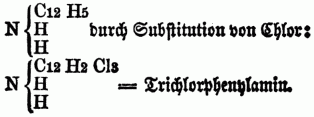
[345] Hierbei wird allerdings die alkalische Eigenschaft der O-n B. mehr od. weniger geschwächt, aber doch die Basicität nicht völlig vernichtet. Chlor u. Brom sind sehr geneigt, 3 Atome Wasserstoff zu ersetzen, Jod dagegen wirkt schwächer u. scheint immer nur 1 Atom zu vertreten. Cyan kann auf diese Weise nicht in die Zusammensetzung der O-n B. eintreten, sondern verbindet sich direct mit denselben zu neuen Alkaloiden. Die meisten O-n B. sind fest u. krystallisirbar, einige jedoch, wie das Veratrin u. Emetin, nur im amorphen Zustande bekannt, andere sind flüssig, wie das Nicotin u. Coniin, einige sogar gasförmig; im reinen Zustand sind fast alle farblos, in höherer Temperatur schmelzbar, theils flüchtig, theils nicht flüchtig. Sie enthalten gewöhnlich nur Kohlenstoff, Stickstoff u. Wasserstoff, zuweilen Sauerstoff u. Schwefel, Chlor, Brom u. Jod. Einige O. B. sind stickstofffrei, wie die Oxyde mancher metallhaltigen Radicale (Kakodyloxyd, Slibäthyloxyd). Die meisten O-n B. bilden mit Säuren krystallisirbare Salze, aus denen sie durch Alkalien od. alkalische Erden ausgefällt werden. Die Sättigungscapacität der O-n B. ist weder abhängig von der Menge des in ihnen enthaltenen Sauerstoffes (denn bei Weitem der größte Theil derselben ist sauerstofffrei), noch von der Menge des Stickstoffes. Wenn sich O. B. mit Sauerstoffsäuren verbinden, so wird stets ein Äquivalent Wasser aufgenommen, die Wasserstoffsäuren verbinden sich mit den O-n B. ohne Wasseraufnahme, wie das Ammoniak. Die Salze der O-n B. werden durch den elektrischen Strom in Säure u. Basis zerlegt: sie werden gewöhnlich gefällt durch starke mineralische Basen, zuweilen durch kohlensaure Alkalien, durch Quecksilberchlorid, Phosphormolybdänsäure, Platinchiorid, Gerbstofflösungen, manche durch Rhodankalium u. durch Pikrinsäure. Einige O. B-n können mit Salzsäure saure Salze bilden, welche sich dann mit 2 Äquivalenten Platinchlorid verbinden. Manche verbinden sich sogar mit Schwefelsäure u. Thonerde zu Alaunen. Viele O. B. finden sich fertig gebildet in der Natur, namentlich im Pflanzenreiche, weniger zahlreich sind die aus dem Thierreich, die letzteren besitzen nur schwach basische Eigenschaften u. sind meist Auswurfsstoffe. Sehr groß ist die Zahl der künstlich darstellbaren O-n B., von denen jedoch nur sehr wenige auch fertig gebildet sich in der Natur finden. Von Wichtigkeit für die Medicin sind bes. die Pflanzenalkaloide, welchen ein großer Theil der dem Pflanzenreich entnommenen Arzneimittel ihre Wirksamkeit verdankt; sie sind zum Theil energische tonische Mittel, zum Theil scharfe Reizmittel, viele sind heftige Gifte u. wirken theils narkotisch auf Gehirn u. Rückenmark, theils als heftige Acria, welche leicht Entzündung der Eingeweide verursachen. Wirksame Gegenmittel gegen Vergiftungen mit O-n B. sind Galläpfeltinctur, Magnesiahydrat, iodhaltiges Jodkalium. Die Ausmittelung der Vergiftung mit Pflanzenbasen ist häufig sehr schwierig, oft auch unmöglich; es kommt hierbei darauf an, die Pflanzenbase für sich od. ein Salz derselben herzustellen; genügen die chemischen Reactionen nicht, so wendet man physiologische Erkennungsmittel an, indem man z.B. geringe Mengen von der möglichst concentrirten Substanz, welche auf die organische Basis untersucht werden soll, Fröschen eingibt od. auf die Pupille von Kaninchen od. anderen Thieren bringt u. die Wirkung beobachtet; viele O. B. besitzen nämlich die Eigenschaft, die Pupille zu vergrößern.
Die flüchtigen Pflanzenbasen gewinnt man durch Destillation derbetreffenden Pflanzentheile mit einem fixen Alkali; das Destillat wird mit Schwefelsäure gesättigt u. das durch Umkrystallisiren aus Alkohol gereinigte schwefelsaure Salz mit wässerigem Alkali destillirt, aus dem Destillat wird durch Verdampfen des Wassers das Alkaloid rein gewonnen. Die nicht flüchtigen Pflanzenalkaloide werden mit Wasser aus den Pflanzen gezogen, welchem etwas Schwefelsäure od. Salzsäure beigemischt ist, die Flüssigkeit wird dann mit doppelkohlensaurem Alkali, mit Kalk od. Magnesia gefällt u. aus dem ausgewaschenen u. getrockneten Niederschlag das Alkaloid mit Alkohol ausgezogen. Künstlich können O. B. auf sehr verschiedene Art u. Weise erhalten werden. Viele bilden sich bei der trockenen Destillation von stickstoffhaltigen Substanzen des Thier- u. Pflanzenreichs für sich od. mit einem Alkali; so enthält namentlich der Steinkohlentheer eine ganze Reihe O-r B.; manche O. B. entstehen auch schon beim Kochen von stickstoffhaltigen Substanzen mit Kali; auch aus Alkaloiden selbst bilden sich bei der Behandlung mit Basen oft andere Alkaloide, so entsteht aus dem Thiosinnamin durch Bleioxyd Sinnamin; durch Erhitzen von Codeïn mit Natronkalk Methylamin u. Propylamin. Aus neutralen Amiden od. ihnen verwandte Substanzen entstehen durch Einwirkung starker Basen od. starker Säuren O. B., so aus dem Furfuramid durch Kali das Furfurin, aus dem Kreatin durch Säuren das Kreatinin, durch schmelzenden Baryt das Sarkosin. Eine Anzahl merkwürdiger Alkaloide erhält man ferner bei der Behandlung der Nitroverbindungen mit Schwefelwasserstoff od. Schwefelammonium. Analog der Bildung von Ammoniak bei der Zersetzung des Cyansäurehydrats od. des Harnstoffs mittelst Kali, werden auch O. B. bei der Einwirkung von Ätzkali auf cyansäure Äther od. dem Harnstoff homologe Körper erhalten. Stickstofffreie phosphorhaltige Basen entstehen durch Destillation von Chloräther über Phosphorcallum od. bei der Einwirkung von Phosphorchlorür auf Zinkmethyl, Zinkäthyl etc. in einer Kohlensäureatmosphäre. Flüchtige Basen erhielt Hofmann bei der Einwirkung von Ammoniak auf Jod- od. Bromäther; es lassen sich auf diese Weise Basen darstellen, in denen 2, u. solche, in denen alle 3 Atome Wasserstoff durch Alkoholradical vertreten sind; erwärmt man die letzteren, deren allgemeine Formel also
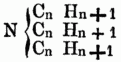
ist, mit Jodäther, so erhält man eine dem Jodammonium analoge Verbindung, in welcher aller Wasserstoff durch Alkoholradical ersetzt ist; die darin enthaltene, dem Ammoniumoxyd entsprechende Basis kann durch frisch gefälltes Silberoxyd erhalten werden, ihre Formel ist: N4(CnHn + 1) O. Einige Basen entstehen beim Erhitzen von Alkohol mit Jod- od. Chloralkalimetallen in verschlossenen Röhren auf 300 bis 400°, andere beim Erhitzen von ätherschwefelsauren Kalk mit alkoholischer Ammoniaklösung, noch andere bei längerem Erhitzen von salpetersauren Äthern mit alkoholischer Ammoniaklösung, durch Destilliren der sauren schwefeligsauren Aldehydammoniake mit Ätzkalk. Bei der Einwirkung von Ammoniak auf Metalle od. Metallverbindungen erhält man eine Reihe stickstoffhaltiger Verbindungen, welche Metall enthalten, u. deren Wasserstoff zum Theil auch durch Basyle ersetzbar[346] ist, so z.B. Zinkphenylamid
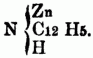
Man theilt die O-n B. nach ihrer chemischen Constitution ein in A) Basen (basylirte Ammoniake) vom Typus Ammoniak (NH3); sie entsprechen den organischen Amiden im weiteren Sinne od. den acidoylirten Ammoniaken, d.h. den Ammoniaken, in denen der Wasserstoff durch ein Säureradical substituirt ist. a) Monamine, welche von 1 Aquivalent H H H } N abgeleitet sind; sie enthalten daher nur 1 Äquivalent Stickstoff, außer, wenn durch Untersalpetersäure substituirte Radicale in ihnen vorhanden od. Cyan in die Verbindung eingegangen ist; alle hierher gehörigen O-n B. sind flüchtig, anßer, wenn sie ein Metall enthalten, daher sie durch Destillation mit starken Basen aus ihren Verbindungen ausgeschieden u. rein erhalten werden; sie sind meistens Kunstproducte, gewöhnlich ölige, zum Theil stark riechende Flüssigkeiten von brennendem gewürzhaften Geschmack, einige sind krystallinisch, einige auch gasförmig. Man unterscheidet: aa) primäre Monamine (Amidbasen, primäre Amidbasen), in denen nur 1 Äquivalent Wasserstoff substituirt ist, z.B.:
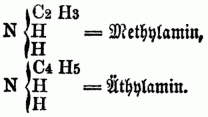
bb) Secundäre Monamine (Imidbasen, secundäre Amidbasen), in denen 2 Äquivalente Wasserstoff substituirt sind, z.B.:
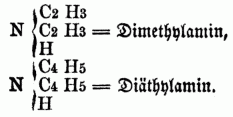
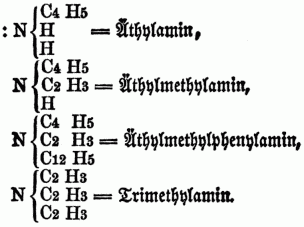
cc) Ternäre Monamine (Nitrilbasen, ternäre Amidbasen), in denen alle 3 Äquivalente Wasserstoff substituirt sind, z.B.:
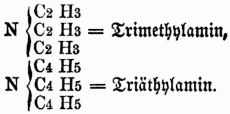
Da auf diese Weise von jedem binären Radical, welches im Stande ist, den Wasserstoff zu substituiren, 3 Basen (eine Amid-, Imid- u. Nitrilbase) abgeleitet werden können, da ferner die 3 Äquivalente Wasserstoff im Typus H H H } N durch drei verschiedene Radicale substituirt werden können, so ergibt sich hieraus eine überaus große Anzahl von organischen Körpern in der Reihe der O-n B. Zu den Monaminen gehören: Methylamin, Äthylamin, Acetylamin, Amylamin, Alkylamin, Propylamin, Butylamin, Anilin, (Phenylamin), Caprylamin, Cumidin, Toluidin, Cymidin, Xylidin, Phtalamin, Naphtalidin, Benzidin, Naphlidin, Phtalidin, Sparteïn. Die Coniinbasen, das Nicotin, Pyridin, Picolin, Collidin, Pyrrhol, Leukolin, Lepidin u. Kryptidin sind Nitrilbasen. b) Diamine u. Triamine, welche dem Typus
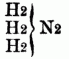
u.
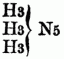
entsprechen, also 2 od. 3 Äquivalente typischen Stickstoff enthalten. Sie entstehen hauptsächlich beim Zusammentreten von zwei- u. dreiatomigen Basylverbindungen (bes. der Chloride u. Bromide) mit Ammoniak od. Monaminen. Zu ihnen gehören: Acediamin Acetonin, Pikramin, Lophin, Glyoxalin, Glykosi, u.a. B) Basen nach dem Typus Ammoniumoxydhydrat. Der Typus NH4O + HO läßt sich auf zweierlei Weise schreiben, nämlich als:
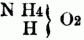
entsprechend dem Typus
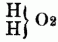
od.
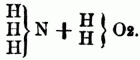
Die Nitrilbasen liefern bei der Behandlung mit Jodäthern Verbindungen, welche 4 Atome basisches Radical mit 1 Atom Stickstoff an Jod gebunden enthalten, also ein Jodammonium darstellen, in welchem 4 Atome Wasserstoff durch ein binäres Radical substituirt sind. Diese Körper liefern mit Silberoxydhydrat das Hydrat eines organischen Ammoniumoxydes, welches sich ganz wie ein starkes Alkali verhält. Es gibt übrigens auch Ammoniumoxydbasen, in denen nicht aller Wasserstoff substituirt ist. Die organischen Ammoniumoxydé sind nicht flüchtig, sondern zerfallen beim Erhitzen in Nitralbasen, Wasser u. einen Kohlenwasserstoff, sie sind nur als Hydrate bekannt; die dem unorganischen Ammonium entsprechenden organischen Ammoniumme sind ebenfalls nicht darstellbar. Von den hierher gehörigen O-n B. sind bereits eine große Anzahl künstlich dargestellt worden u. namentlich ihre Verbindungen mit Jod u. mit Platinchlorid bekannt; z.B.: Tetraäthylammonium = 4 C4H5 + N, Methyltriäthylammonium = 3 C4H5 + C2H3 + N, Tetramylammonium = 4 C10H11 + N, Triäthylphenylammonium = 3C4H5 + C12H5 + N etc. C) Quaternäre organische Basen, sind meist Producte des Pflanzenlebens u. in Beziehung auf ihre chemische Constitution noch unbekannt. Sie enthalten Kohlenstoff, Wasserstoff, Stickstoff u. Sauerstoff, nur die drei Pflanzenbasen Nicotin, Coniin u. Sparteïn sind sauerstofffrei, sie sind nicht flüchtig, fast alle fest, die meisten krystallisirbar. Zu ihnen gehören die Alkaloide des Opiums, ferner das Chelerythrin, Glauein, Strychnin, Brucin, Curarin, Veratrin, Sabadillin, Jervin, Colchicin, Delphinin, Aconitin, Atropin, Daturin, Hyoscyamin, Chinin, Cinchonin, Cinchotin, Cinchonitin, Cinchovatin, Emetin, Berberin, Pelosin, Lobelin, Corydalin, Menispermin, Harmalin, Harmin, Bebeerin, Piperin, Piperidin, Kasseïn (Theïn, Guaranin), Theobromin, Furfurin, Fucufin, Methyluramin, Sarkosin. D) Die organischen Phosphor-, Arsen- u. Antimonbasen. Die Analogie zwischen dem Stickstoff einerseits u. dem Phosphor, Antimon u. Arsen andererseits in den unorganischen Verbindungen (z.B.: NH3, PH3, Sb H3, As H3) setzt sich auch in ihren organischen Verbindungen fort, namentlich aber in den Körpern vom Typus Ammoniak od. Ammoniumoxydhydrat; z.B.: Triäthylamin = N (3 C4H5), Triäthylphosphin = P (3C4H5,), Triäthylarsin = As (3 C4H5) u. Triäthylstibin = Sb (3 C4H5). Bes. bemerkenswerth ist die Analogie zwischen den organischen Ammoniumoxydhydraten u. den Phosphinum-, Arsenium- u. Stibiniumoxydhydraten, nur zerfallen die letzteren beim Erhitzen nicht in Alkohol u. einen Körper vom Typus NH3, sondern in einen Kohlenwasserstoff u. eine 2 Atome Sauerstoff enthaltende Basis, deren Analoga[347] man in der Stickstoffreihe nicht kennt. Die erste Kenntniß dieser Phosphor-, Arsen- u. Antimonbasen verdankt man P. Thénard, später haben Hofmann u. Cahours diese Körper zweckmäßig darzustellen gelehrt, indem sie z.B. Phosphor-, Arsen- u. Antimonchlorür auf Zinkmethyl, Zinkäthyl etc. einwirken ließen. E) Schwefelhaltige Alkalo ide sind bis jetzt nur künstlich hergestellt worden u. sämmtlich aus Aldehyden od. diesen ähnlichen Verbindungen gewonnen, zu ihnen gehören: Thialdin, Thiacetonin, Thiocaprinaldin, Thiovaleraldin, Carbothialdin, Carbothiacetonin.
Pierer's Lexicon. 1857–1865.
