- Auxine
-
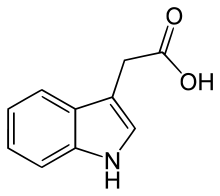 Chemische Struktur von Indol-3-essigsäure, dem wichtigsten Auxin
Chemische Struktur von Indol-3-essigsäure, dem wichtigsten Auxin
Die Auxine (griechisch αυξανω „auxano“ – „ich wachse“) sind eine Gruppe von natürlichen und synthetischen Wachstumsregulatoren mit multipler Wirkung auf Wachstums- und Differenzierungsprozesse bei Gefäßpflanzen und einer spezifischen Wirkung im Protonema der Laubmoose. Die natürlich vorkommenden pflanzlichen Auxine gehören zu den Phytohormonen. Gegenspieler der Auxine sind die Blastokoline. Die Auxine sind in der Fachsprache aufgrund ihrer Wirkung auch unter dem Namen Streckungshormone bekannt. In Pflanzen sind sie essentiell.
Inhaltsverzeichnis
Struktur
Die molekulare Struktur der verschiedenen Auxine ist recht unterschiedlich. Allen gemeinsam ist ein planares aromatisches Ringsystem und ein Rest mit hydrophober Übergangsregion und terminaler Carboxygruppe. Der Aromat kann allerdings recht unterschiedliche Strukturen aufweisen. Wirksam sind Indole aber auch Phenyle sowie ein Naphtylrest. Außerdem variiert die Länge der hydrophoben Übergangsregion (ein bis drei CH2-Gruppen).
Natürliche Auxine
Indol-3-essigsäure(IAA, β-Indolylessigsäure, Indol-3-essigsäure, Heteroauxin) ist der wichtigste Vertreter der Auxine. Sie kommt in allen höheren Pflanzen in geringer Menge (1 bis 100 µg je kg Pflanzenmaterial) vor, und ist auch in niederen Pflanzen und Bakterien vertreten. Sie ist das stärkste und häufigste Auxin und somit für den Großteil der natürlichen Auxineffekte verantwortlich. Kommerziell wird IAA jedoch nicht verwendet, da sie in wässriger Lösung verhältnismäßig instabil ist.
Indol-3-essigsäure findet man im Pflanzengewebe entweder in freier Form und über die Carboxygruppe esterartig an myo-Inosit, Glukose oder Galaktose oder peptidartig an Aminosäuren, wie Asparaginsäure oder Tryptophan, gebunden vor. Diese Indol-3-essigsäurederivate werden als Auxinkonjugate bezeichnet und als Glykosyl, myo-Inosityl- bzw. Peptidylkonjugate unterschieden. Auxinkonjugate sind alle biologisch inaktiv. Sie spielen bei der Regulation des Auxinstoffwechsels eine wichtige Rolle. In verschiedenen Pflanzen finden sich weitere strukturverwandte Verbindungen der Indol-3-essigsäure wie zum Beispiel 4-Chlorindolylessigsäure, Indolylethanol, Indolylacetamid, Indolylacetonitril und Indolylacetaldehyd. Diese dienen zum Teil als Biosynthesevorstufen (Auxinvorstufen).
Weitere natürliche Auxine sind Phenylessigsäure (PAA), 4-Chloroindol-3-essigsäure (4-Cl-IAA)und Indol-3-buttersäure (IBA). IBA wurde lange als rein synthetisches Auxin betrachtet, mittlerweile jedoch auch aus Mais und anderen Pflanzen (zum Beispiel Senfplanzen) isoliert.
Synthetische Auxine
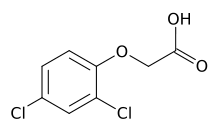
Von den synthetischen Verbindungen mit Auxinaktivität sind vor allem β-Indolylbuttersäure und Indolylpropionsäure, Phenyl- und 1-Naphthylessigsäure sowie Phenoxy- und Naphthoxyessigsäuren von praktischer Bedeutung. Außerdem gibt es noch 2,4-Dichlorphenoxyessigsäure und Dicamba.
Sie werden künstlich im Labor hergestellt. Dabei wird eine alkoholische Lösung (im %-Bereich) unter eine Trägersubstanz (Talkum oder Aktivkohle) gerührt. Nach dem Trocknen entsteht ein Staub, in den zum Beispiel die Stecklingsbasen eingetaucht werden können. Seltener wird die Lösung direkt auf die Pflanzen versprüht. Ebenfalls selten wird der Wuchsstoff direkt ins Gießwasser gegeben.
Kommerziell angebotene Produkte sind zum Beispiel: PhytoBoost® (Wirkstoffe: Indol-3-essigsäure, Vitamine) als einziges Produkt mit dem natürlichen Auxin IAA, ferner SuperThrive® (Wirkstoffe: Naphthylessigsäure und viele andere, nicht veröffentlichte Komponenten), Seradix® (Wirkstoff: β-Indolybuttersäure), das in 3 verschiedenen Konzentrationen erhältlich ist (0,2 %, 0,4 % und 0,8 %) oder Rhizophon®/Chryzopon® (Wirkstoffe: β-Indolybuttersäure oder Naphtylessigsäure in verschiedenen Konzentrationen).
Biosynthese
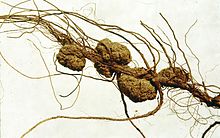 Pflanzengallen werden von Agrobacterium tumefaciens-Bakterien verursacht. Diese produzieren und setzen Auxin und Cytokinin frei, die die normale Zellteilung an der Infektionsstelle stören und zu Wucherungen führen
Pflanzengallen werden von Agrobacterium tumefaciens-Bakterien verursacht. Diese produzieren und setzen Auxin und Cytokinin frei, die die normale Zellteilung an der Infektionsstelle stören und zu Wucherungen führen
Die Bildung von Indol-3-essigsäure (IAA) erfolgt in jungen, sich schnell teilenden und wachsenden Geweben, insbesondere im Spross, Koleoptil und in Sproßspitzen, jungen Blättern, sich entwickelnden Samen und dem aktiven Kambium. Auch im apikalen Wurzelmeristem wird IAA gebildet. IAA ist mit Tryptophan (Trp) strukturell verwandt. In der Tat gibt es einen Tryptophan-abhängigen und einen Trp-unabhängigen Syntheseweg, bei dem die Biosynthese aus einer Tryptophanvorstufe erfolgt.
Beim Tryptophan-abhängigen Weg sind insgesamt vier Stoffwechselwege bekannt. Es sind der Tryptamin-Weg (TAM), der Indol-3-pyruvat-Weg (IPA), der Indol-3-acetonitril-Weg (IAN) und ein Stoffwechselweg, der nur in Bakterien (A. tumefaciens) vorkommt. In Pflanzen sind die ersten beiden Wege am weitesten verbreitet. Die Entdeckung von Mutanten, welche Tryptophan nicht selbst herstellen konnten, aber dennoch IAA enthielten, warf Fragen nach einem Trypthophanunabhängigen Syntheseweg auf. Diese Mutante waren überdies auch nicht in der Lage, durch im Überschuss verabreichtes Trp aus diesem Auxin herzustellen. Man hat durch isotopenmarkierte Fütterungsversuche festgestellt, dass der Tryptophanvorläufer Indol-3-glycerinphosphat als Vorläufer der Auxinsynthese dient. Genauere Untersuchungen ergaben aber, dass es sich bei der IAA- Bildung um eine chemische Zersetzung von Indol-3-glycerinphosphat handelt, welche nicht von Enzymen katalysiert wird.
Transport
Der Transport von Auxin erfolgt überwiegend vom Spross zur Wurzelspitze. Die Inaktivierung der Auxine geschieht durch enzymatisch katalysierten oxidativen Abbau oder durch Konjugatbildung zur Speicherung.
Auxin ist das einzige polar transportierte Phytohormon. Der Transport erfolgt entweder parenchymatisch oder über die Leitgefäße (im Spross basipetal, in der Wurzel akropetal bzw. über kurze Strecken auch basipetal). Für den Transport im Phloem ist eine chemische Modifikation notwendig. Hierbei findet eine kovalente Bindung mit Glucose, myo-Inositol oder Aspartat statt. Diese IAA-Konjugate sind physiologisch inaktiv und es erfolgt am Zielgewebe eine Spaltung der kovalenten Bindung.
Den Transport kann man in zwei Gruppen unterteilen:
- über längere Strecken: im Phloem, vorwiegend basipetal, etwa 10 bis 20 cm/h
- über kürzere Strecken: polarer Transport von Zelle zu Zelle im Parenchym, ebenfalls basipetal mit Hilfe zweier Anionen-Transporter, einem Auxin-Influx-Carrier (zum Beispiel AUX1 in Arabidopsis) und einem Auxin-Efflux-Carrier (PIN Proteine). Influx-Carrier befinden sich vor allem in der apikalen Zellmembran einer Zelle, während die Efflux-Carrier entgegengesetzt in der basalen Membran vorkommen. AUX1 funktioniert als Protonen-Symporter (sekundär aktiver Transport), d. h. deprotoniertes Auxin (anionische Form) wird zusammen mit 2 Protonen in die Zelle hinein transportiert. Außerdem kann Auxin durch den niedrigen pH-Wert (etwa 5,5) in der Zellwand in protonierter Form durch die Membran diffundieren. Durch den basischen pH [etwa 7,0) in der Zelle deprotoniert Auxin und kann nicht mehr einfach durch die Membran aus der Zelle diffundieren. Es wird durch PIN-Proteine am basalen Ende der Zelle wieder aktiv aus der Zelle heraus geschleust. Derselbe Vorgang wiederholt sich in der nächst unteren Zelle, und so kommt ein polarer Transport mit einer Geschwindigkeit von etwa 1 cm/h zustande.
In Arabidopsis gibt es eine ganze Genfamilie von AtPIN-Proteinen. Ihr Name leitet sich von Arabidopsis thaliana und dem blattlosen (englisch pin – Nadel) Phänotyp entsprechender Mutanten ab und sie sind mittlerweile recht gut untersucht. Der gerichtete Transport von Zelle zu Zelle kann durch veränderte Expression der PIN-Carrier modifiziert werden. Dadurch kann der IAA-Strom in der Pflanze umgelenkt werden. Auf diesem Effekt beruhen zum Beispiel der Phototropismus und der Gravitropismus.
Wirkung
Auxine haben eine vielfältige, allgemein fördernde Wirkung auf die Gesamtentwicklung von höheren Pflanzenarten im komplexen Zusammenspiel mit anderen Phytohormonen. Auxine wirken besonders auf die Zellstreckung, vor allem von Koleoptilen und in den Sproßachsen. Dies ist der klassische Auxineffekt. Sie regen die Kambiumtätigkeit an, beeinflussen Zellteilung, Apikaldominanz, Abszission, Phototropismus und Gravitropismus und andere Wachstums- und Entwicklungsprozesse.
Die kontrovers diskutierte Pflanzenneurobiologie schreibt Auxin darüber hinaus eine neurotransmitterartige Wirkung zu.[1]
Konzentrationsabhängige Wirkung
In hohen Dosen wirken Auxine überraschenderweise stark wachstumshemmend. Der Grund hierfür liegt in organspezifischen Konzentrationsoptima. Dabei wirken geringere Dosen des Hormons bis zu einer gewissen Konzentration fördernd auf das Zellstreckungswachstum, während zu hohe Konzentrationen das Streckungswachstum hemmen. In der Sprossachse liegt die optimale Konzentration in der Regel höher als in der Wurzel, weshalb es dort schon bei geringeren Auxinkonzentrationen zur Wachstumshemmung kommt. Dies spielt möglicherweise beim Gravitropismus eine wichtige Rolle. Die Auxinwirkung wurde auch bei der Entwicklung von selektiv wirkenden Herbiziden (zum Beispiel 2,4-Dichlorphenoxyessigsäure oder kurz 2,4 D, und 2,4,5-Trichlorphenoxyessigsäure oder kurz 2,4,5-T) genutzt. Das Herbizid 2,4-D wirkt selektiv auf dikotyle Unkräuter, indem es diese zu übermäßigem Wachstum anregt und so deren Biosynthesekapazität erschöpft. Monokotyle Pflanzen (wie beispielsweise die Getreidepflanzen) reagieren nicht auf 2,4-D.
Physiologische Wirkung
Streckungswachstum
Die hauptsächliche Wirkung von Auxin ist die Förderung des zellulären Streckungswachstums. Das beruht auf zwei Effekten:
- Säurewachstum: Die Säurewachstumstheorie (englisch acid growth theory) wurde schon 1971 von Hager entdeckt und vielfach bestätigt. IAA bewirkt die Aktivierung von H+ATPasen sowie die Induktion ihrer Neusynthese und den Export ihrer Bausteine in die Zellmembran. Dort bewirken sie durch Ausschleusen von Protonen eine Ansäuerung der Zellwand. Dadurch werden unter Mithilfe von Expansinen Wasserstoffbrückenbindungen zwischen Zellwandfasern, nämlich den Xyloglucane und Cellulosemikrofibrillen gespalten. Durch die herrschende Druckspannung der Zellen weitet sich die Zellwand (vor allem quer zur Richtung der Fibrillen) und es kommt zur Zellstreckung. An dieser Auxin-Wirkung ist wahrscheinlich das Auxinbindeprotein 1 (ABP1; siehe unten) beteiligt.
- Zellwandsynthese: Neben dem eigentlichen Streckungsvorgang induziert IAA auch die Neubildung von Zellwandbausteinen und damit die Erweiterung Zellwand parallel zum Streckungswachstum. Diese Auxin-Wirkung erfolgt über direkte Geninduktion (siehe unten).
Dadurch dass der Transport von Auxin gerichtet stattfindet, erfolgt auch die Zellstreckung nach einem entsprechenden Muster. Darauf beruhen mehrere Auxinwirkungen:
- Phototropismus: Pflanzen können die Lichtverhältnisse ihrer Umgebung durch sogenannte Photorezeptoren wahrnehmen und ihr Wachstum sowie ihre Entwicklung darauf ausrichten. Das Wachstum zum Licht hin wird als Phototropismus bezeichnet. In höheren Pflanzen sind die entsprechenden Photorezeptoren Phototropine. Bei ungleicher Belichtung des Sprosses kommt es unter anderem zum Ausfall von PIN-Proteinen auf der Lichtseite. Dadurch wird der Auxin-Strom in der Pflanze auf die Schattenseite umgelenkt. Dort erfolgt verstärke Zellstreckung, so dass sich die Pflanze zum Licht krümmt. Man sagt das Sprosswachstum erfolgt positiv phototrop.
- Gravitropismus: Durch bestimmte Sensorsysteme (diskutiert werden vor allem Amyloplasten und Golgi-Vesikel) in der Wurzel kann die Schwerkraft wahrgenommen werden. Kippt man eine Pflanze zur Seite, so wird der Auxin-Strom durch PIN-Verlagerung auf die Unterseite der Wurzel umgeleitet. Durch die hohe Auxin-Empfindlichkeit der Wurzel wirkt dieser Auxin-Strom hemmend auf die Zellstreckung der Unterseite, so dass die Wurzel sich nach unten krümmt. Das Wachstum erfolgt in der Wurzel also positiv gravitrop. Umgekehrt lässt sich beobachten dass der Spross der Pflanze sich nach dem Kippen nach oben krümmt; das Sprosswachstum ist also negativ gravitrop.
Dies beruht wahrscheinlich auf dem oben erwähnten hoheren Konzentrationsoptimum von Auxin im Spross, welches hier eine fördernde Wirkung auf die Zellteilung hat.
Apikale Dominanz
Eine weitere wichtige Wirkung von Auxin ist die Apikaldominanz. Dabei hemmt in der Sprosspitze gebildetes Auxin das Austreiben von lateralen Seitenknospen. Gegenspieler ist hier Cytokinin, welches das Austreiben von Seitenknospen (zum Beispiel nach entfernen der Sprossspitze fördert. Der genaue Mechanismus der Apikaldominanz ist jedoch noch umstritten. Ein Einfluss der auxinbedingten Induktion der Ethylenbiosynthese wird diskutiert.
Zellteilung und Differenzierung
Zusammen mit den Phytohormon Cytokinin fördert Auxin auch das Teilungswachstum und die Differenzierung von Zellen.
- Zellteilung: Die Zellteilung wird durch Regulation des Zellzyklus gesteuert. Auxine, Cytokinine, Gibberelline und Brassinosteroide wirken fördernd, Abscisinsäure und Jasmonsäure hemmend. Die Wirkung der fördernden Phytohormone beruht auf der Genaktivierung von Cyclinen und cyclin-abhängigen Kinasen (CDKs).
Speziell handelt es sich um Cyclin D sowie CDK A für den Übergang von der G1- in die S-Phase und die Cycline A und B sowie CDK A und B für den Übergang von der G2- in die M-Phase.
- Zelldifferenzierung: Für die Differenzierung ist das Mengenverhältnis von Auxin zu Cytokinin entscheidend. Bei einem hohen Auxin:Cytokinin-Verhältnis bildet sich Wurzelgewebe, bei einem niedrigen Auxin:Cytokinin-Verhältnis bildet sich ein Spross. Diese Wirkung wird zum Beispiel in der Organogenese in Gewebekulturen ausgenutzt. In der Pflanze kommt es bei hoher Auxinkonzentration zu vermehrter Bildung von Adventiv- und Seitenwurzeln. Außerdem wird im Kambium bei einem Auxin-Cytokinin-Verhältnis von ungefähr 1:1 Xylemgewebe gebildet. Das spielt vor allem in der Pflanzenentwicklung und nach Verwundung eine Rolle.
Auxin steuert auch die Fruchtbildung und -entwicklung. Nach der Bestäubung regt IAA aus dem Pollen die Zellteilungen für den Fruchtansatz an, das spätere Streckungswachstum im Fruchtgewebe wird von IAA aus den sich entwickelnden Samen ausgelöst. Äußerlich zugeführtes Auxin führt bei vielen Pflanzen zur Parthenokarpie, was zum Beispiel in der Agrikultur genutzt wird um die Fruchtbildung zu synchronisieren oder zum Beispiel kernlose Früchte wie Tomaten, Gurken, etc. zu erzielen. Im Embryo führt der Konzentrationsgradient von Auxin zur Musterbildung und bestimmt damit welcher Teil sich zu Wurzel, Spross und Kotyledonen entwickelt.
Im Protonema der Laubmoose, wie zum Beispiel Physcomitrella patens, induzieren Auxine spezifisch den Übergang von Chloronema zu Caulonema. Damit geht eine Änderung in der Zellzykluskontrolle einher.[2]
Seneszenz
Auxin verzögert die Seneszenz und verhindert den Abwurf von Blättern, Blüten und Früchten, indem es die Ausbildung von Trenngeweben hemmt. Gegenspieler sind Abscisinsäure und vor allem Ethylen. Höhere Konzentrationen von IAA fördern allerdings die Enthylenbiosynthese.
Molekulare Wirkung
Die molekulare Wirkung von Auxin ist noch nicht vollständig verstanden. Als erstes wurde in den 1980er Jahren ein Auxinrezeptor mit das sogenannte Auxinbindeprotein 1 (ABP1) entdeckt, welches Auxine spezifisch bindet. ABP1 interagiert mit einem noch nicht identifizierten Dockingprotein an der Plasmamembran. Die Weiterleitung des Signals ist unbekannt, bewirkt jedoch die Modulation von Membrantransportproteinen (insbesondere der Protonenpumpe). Für die Auxin-induzierte Veränderung der Expression bestimmter auxininduzierter Gene wurde ABP1 jedoch verworfen.
Die auxininduzierte Genexpression lässt sich in eine schnelle, direkte und eine etwas langsamere, indirekte Wirkung unterteilen. An der direkten Genexpression sind unter anderem sogenannte „auxin response factors“ (ARFs) beteiligt, die an „auxin response elements“ (Aux-Res; Sequenz TGTCTC) der DNA binden und die Genexpression kontrollieren. Dabei bewirkt Auxin im Grunde genommen die Aufhebung einer Gen-Hemmung. Das ist auch der Grund für die schnelle Wirkung. Im Normalzustand auxinregulierter Gene ist ARF zusammen mit einem Repressor („AUX/IAA“) als Heterodimer an das AUX-Res gebunden. Das Gen wird nicht expremiert. Wenn Auxin hinzukommt bindet und aktiviert es den sogenannten „SCF-Komplex“, eine Ubiquitin-Protein-Ligase (mit TIR1), die den Repressor ubiquitiniert und damit zu Abbau markiert. Der Repressor wird vom Proteasom abgebaut, und das Gen kann transkribiert werden. So werden beispielsweise Zellwandbausteine für die Zellstreckung gebildet. Viele direkt auxin-gesteuerte Gene entstammen unter anderem aus den Genfamilien AUX/IAA, SAUR (Small Auxin Up RNAs) und GH3. Ein Kaliumkanal (ZMK1) konnte kürzlich als wachstumsrelevantes auxininduziertes Protein identifiziert werden. Die indirekte Genexpression erfolgt über die gerade beschriebene direkte Induktion von Transkriptionsfaktoren. Diese ermöglichen ihrerseits die Expression von weiteren Genen.
Abbau
Auxine werden von Enzymen (Peroxidasen) und UV-Strahlen abgebaut, was jedoch nur eine sehr geringe Rolle spielt. Der genau Reaktionsablauf des enzymatischen Abbaus ist noch unbekannt. Diskutiert werden IAA-Oxidasen, die IAA von der Seitenkette her abbauen und ein Abbau über die Spaltung des Indolkernes.
Nachweis
Der Nachweis und die quantitative Bestimmung von Auxinen erfolgte früher meist durch spezifische Biotestsysteme, zum Beispiel den Haferkoleoptilen-Krümmungstest. Heutzutage werden Gaschromatographie bzw. Gaschromatographie/Massenspektrometrie sowie Immunassays zur Auxin-Analytik eingesetzt.
Verwendung
Indol-3-essigsäure und vor allem einige synthetische Auxine wie 2,4-D haben als Wachstumsregulatoren in der Landwirtschaft sowie im Obst- und Gartenbau (Fruchtausdünnung, Förderung des Fruchtansatzes) breite Anwendung gefunden. Beispiele sind hier die Stecklingsbewurzelung oder als selektiv wirkende Herbizide im Getreideanbau, Baumwoll-, Sojabohnen- und Zuckerrübenkulturen. Militärisch wurde der Butylester der 2,4,5-Trichlorphenoxyessigsäure im Vietnamkrieg als „Agent Orange“ zur Entlaubung benutzt. Die Schädigungen von Personen am Boden und bei den Flugzeugmannschaften beruhten auf der Kontamination durch polychlorierte Dibenzodioxine und Dibenzofurane.
Auxine spielen eine wichtige Rolle bei der Baumwollfaserentwicklung. Forschern der Southwest University (Chongqing) gelang mithilfe der Gentechnik eine Erhöhung der IAA-Produktion in der Epidermis der Pflanze zu Beginn des Faserwachstums. Dies führt zu einer Zunahme der Zahl und Länge verwendbarer Fasern (Lint) und einer Abnahme der Zahl der nicht zu Textilien verarbeitbaren Fasern (Linter). Feldversuche über vier Jahre ergaben, dass der Lintertrag bei den transgenen Pflanzen konsistent um mehr als 15% höher war als bei den konventionellen Kontrollgruppen. Zudem verbesserte sich die Feinheit der Fasern.[3][4]
Einzelnachweise
- ↑ Eric D. Brenner, Rainer Stahlberg et al.: Plant neurobiology: an integrated view of plant signaling. Trends in Plant Science 11 (8), 2006, S. 413–419
- ↑ Eva L. Decker, Wolfgang Frank, Eric Sarnighausen, Ralf Reski (2006): Moss systems biology en route: Phytohormones in Physcomitrella development. Plant Biology 8, 397-406. doi:10.1055/s-2006-923952
- ↑ Mi Zhang, Xuelian Zheng, Shuiqing Song, Qiwei Zeng, Lei Hou, Demou Li, Juan Zhao, Yuan Wei, Xianbi Li, Ming Luo, Yuehua Xiao, Xiaoying Luo, Jinfa Zhang, Chengbin Xiang & Yan Pei: Spatiotemporal manipulation of auxin biosynthesis in cotton ovule epidermal cells enhances fiber yield and quality. Nature Biotechnology, Band 29, S. 453-458. doi:10.1038/nbt.1843
- ↑ Z Jeffrey Chen & Xueying Guan: Auxin boost for cotton. Nature Biotechnology, Band 29, S. 407-409. doi:10.1038/nbt.1858
Literatur
- Klaus Grossmann, Hauke Hansen: Auxin-Herbizide: Wirkstoffe mit Janusgesicht. Biologie in unserer Zeit 33 (1), S. 12–20 (2003), ISSN 0045-205X
- Lincoln Taiz und Eduardo Zeiger: Plant Physiology – Das Original mit Übersetzungshilfen. Spektrum Akademischer Verlag; 4. Auflage 2007; ISBN 978-3-8274-1865-4
- Vanneste, S. und Friml, J. (2009): Auxin: a trigger for change in plant development. In: Cell 136 (6); 1005–1016; PMID 19303845; doi:10.1016/j.cell.2009.03.001
Weblinks
- Plant Physiology – zusätzliche Informationen über Auxine (engl.)
- Botanik online Peter von Sengbusch: Auxine
- plant-hormones.info Auxins (engl.)
Kategorien:- Chemikaliengruppe
- Phytohormon
- Landwirtschaft
Wikimedia Foundation.