- Amifostin
-
Strukturformel 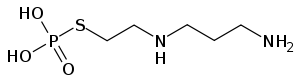
Allgemeines Freiname Amifostin Andere Namen - S-2-[(3-Aminopropyl)amino] ethyldihydrogenmonothiophosphat
- S-2-[3-Aminopropylamino]- ethylthiophosphorsäure
- S-2-(3-Aminopropylamino)- ethylphosphorothioat
- WR-2721
- Ethiophos
- Markenname: Ethyol
Summenformel C5H15N2O3PS CAS-Nummer 20537-88-6 PubChem 2141 CID 2141 ATC-Code V03AF05
DrugBank APRD00021 Arzneistoffangaben Wirkstoffklasse Verschreibungspflichtig: Ja Eigenschaften Molare Masse 214,22 g·mol−1 Schmelzpunkt Zersetzung bei 160–161 °C (als Monohydrat)[1]
Sicherheitshinweise Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln GHS-Gefahrstoffkennzeichnung [2] 
Achtung
H- und P-Sätze H: 302 EUH: keine EUH-Sätze P: keine P-Sätze [2] EU-Gefahrstoffkennzeichnung [2]
Xn
Gesundheits-
schädlichR- und S-Sätze R: 22 S: 26-36 LD50 - 842 mg/kg (Maus, oral)[3]
- 826 mg/kg (Ratte, oral)[3]
- 635 mg/kg (Meerschweinchen, oral)[3]
- >10.000 mg/kg (Affe, oral)[3]
- 557 mg/kg (Maus, intravenös)[3]
- 396 mg/kg (Ratte, intramuskulär)[3]
- 514 mg/kg (Maus, intramuskulär)[3]
- 418 mg/kg (Ratte, intraperitoneal)[3]
- 321 mg/kg (Maus, intraperitoneal)[3]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Amifostin, Entwicklungscode WR-2721, ist der Internationale Freiname für ein zytoprotektives Arzneimittel.
Inhaltsverzeichnis
Beschreibung
Amifostin ist ein phosphorylierter Aminothioalkohol. Als Prodrug[4][5] wird Amifostin durch membranständige alkalische Phosphatasen der Endothelzellen in den eigentlichen Wirkstoff 2-((Aminopropyl)amino)ethanthiol (Entwicklungscode WR-1065) zerlegt.[6][7] Amifostin selbst ist inaktiv.[8]
In einer Vielzahl von präklinischen Studien konnte an Modellorganismen wie beispielsweise Mäusen, Hunden und Affen eine chemo- und radioprotektive Wirkung nachgewiesen werden.[5] In klinischen Studien wurde zudem eine unterstützende Wirksamkeit bei etablierten Therapiekonzepten festgestellt.[9]
Amifostin ist der erste und bisher einzige[10] zugelassene Radioprotektor.[11] Seit 1995 ist es in Deutschland und den Vereinigten Staaten zur Nieren-, Blut- und Nerven-Protektion mittels intravenöser Applizierung zugelassen. Seit 1999 ist es auch für die Behandlung und Prävention einer Mundtrockenheit zugelassen.[9]
Wirkmechanismus
Organ bzw. System Schutzfaktor[12] Knochenmark 2,4–3,0 Immunsystem 1,8–3,4 Haut 2,0–2,4 Dünndarm 1,8–2,0 Colon 1,8 Lunge 1,2–1,8 Speiseröhre 1,4 Niere 1,5 Leber 2,7 Speicheldrüse 2,0 Mundschleimhaut >1 Hoden 2,1 Die zellschützende (zytoprotektive) Wirkung von Amifostin, beziehungsweise von seinem Stoffwechselprodukt WR-1065, beruht auf dem Abfangen freier Radikale und reaktiver Sauerstoffspezies (ROS), dem Schutz der DNA, der Beschleunigung der DNA-Reparatur und der Induktion eines zellulären Sauerstoffmangels Hypoxie. Letzteres reduziert die Bildung von freien Radikalen und reaktiven Sauerstoffspezies.[13]
Amifostin wirkt selektiv in gesunden Zellen. In allen bisherigen Studien wurde keine Protektion eines Tumors beobachtet[9][14] – bösartiges (malignes) Gewebe profitiert nicht von der Wirkung von Amifostin.[15][16] Dies hat mehrere Ursachen. Eine davon ist die schlechte Blutversorgung (Hypovaskularisierung) vieler Tumoren, die den Transport des Wirkstoffes zum Tumor – im Vergleich zum gesunden Gewebe – einschränkt. Auch der niedrige pH-Wert im Tumor und seiner näheren Umgebung – bedingt durch eine Gewebsazidose, die durch eine anaerobe Glykolyse (Warburg-Effekt) hervorgerufen wird – trägt zur zytoprotektiven Selektivität bei. Zudem sind die alkalischen Phosphatasen im Tumorgewebe wesentlich weniger stark exprimiert. Von den in Tumoren vorherrschenden sauren Phosphatasen wird Amifostin nicht dephosphoryliert.[9]
Ist WR-1065 als aktive Substanz von den Zellen aufgenommen worden, so kann es durch das Abfangen freier Radikale, die Senkung des Sauerstoffgehaltes in der Zelle und die Reaktion und Inaktivierung mit zytotoxischen Wirkstoffen[17][18] die DNA im Zellkern vor Schäden schützen, beziehungsweise die Reparaturmechanismen fördern.[9][19]
Über diese Wirkungen hinaus konnten weitere schützende Effekte von Amifostin festgestellt werden. So stimuliert es die hämatopoetischen Stammzellen, modifiziert die Genexpression und Enzymaktivitäten, und zeigt eine Inhibierung der Apoptose.[4][9] Möglicherweise schützt Amifostin auch vor der Entstehung sekundärer, therapiebedingter Tumoren.[9] In vivo konnte eine Erhöhung der Widerstandsfähigkeit gesunder Zellen gegenüber ionisierender Strahlung, sowie gegen Alkylantien, wie beispielsweise Stickstoff-Lost-Derivaten, Cyclophosphamid oder Melphalan, sowie anderer Zytostatika wie Cisplatin, Anthracyclinen und Taxanen[19] um das bis zu Dreifache gemessen werden.[16]
Pharmakokinetik
Die Plasmahalbwertszeit von Amifostin liegt bei ungefähr acht Minuten; die Verteilungshalbwertszeit bei etwa 0,8 Minuten.[20][21][22][9] Nur etwa 4 % des Amifostin ist an Plasmaproteine gebunden.[1]
Die kurze Plasmahalbwertszeit ergibt sich vor allem durch die schnelle Verstoffwechselung in WR-1065, das selbst eine Plasmahalbwertszeit von ungefähr 11 Minuten hat. WR-1065 wird von den Zellen schnell aufgenommen beziehungsweise weiter in ein Disulfid (WR-33278)[18] metabolisiert.[9] Amifostin ist oral nicht verfügbar.[1]
In präklinischen Studien wurde festgestellt, dass Amifostin selektiv nahezu alle gesunden Gewebe vor den zytotoxischen Auswirkungen einiger Chemotherapeutika, sowie der Strahlentherapie schützen kann. Der Anreicherungsfaktor von WR-1065 in gesundem Gewebe im Vergleich zu malignem Gewebe liegt bei etwa 100:1.[23][11] Es reichert sich vor allem in Knochenmark, Speicheldrüse, Nieren und Herz, sowie Leber und Dünndarmschleimhaut an.[19] In Tiermodellen wird die Gewebe-Spitzenkonzentration innerhalb von 5 bis 15 Minuten erreicht. Über den Urin werden nur geringe Mengen Amifostin, im Bereich von 1 bis 4 % der injizierten Menge, ausgeschieden.[9][22][21]
Amifostin kann die Blut-Hirn-Schranke nicht passieren. Das in vielen Fällen bei der Radiotherapie dosislimitierende Zentralnervensystem wird deshalb von Amifostin nicht geschützt.[24][25][11]
Anwendung
Amifostin wird intravenös, meist als Kurzinfusion appliziert. Die übliche Dosis vor einer Chemotherapie beträgt 740 bis 900 mg/m² Körperoberfläche und vor einer Radiotherapie 250 bis 350 mg/m².[13] Diese Wirkstoffmenge wird üblicherweise etwa eine halbe Stunde vor einer Radiatio als fünfzehnminütige Kurzinfusion verabreicht.[26]
Seit 1995 ist es in Deutschland und den Vereinigten Staaten zur Nieren-, Blut- und Nerven-Protektion mittels intravenöser Applizierung zugelassen. Seit 1999 ist es auch für die Behandlung und Prävention einer Mundtrockenheit zugelassen.[9][13] Amifostin ist der erste zugelassene Radioprotektor.[11]
Die präventive Anwendung von Amifostin in der Raumfahrt, als Radioprotektor gegen die durch Sonneneruptionen (solar particle events, SPE) hervorgerufenen Strahlenbelastungen, wird diskutiert.[27]
Im Modellorganismus Farbratte konnten durch ionisierende Strahlung verursachte Nephropathien durch die Inhibierung des oxidativen Stresses deutlich reduziert werden.[28]
Nebenwirkungen
Zu den schwerwiegenden sehr häufigen Nebenwirkungen nach der Infusion von Amifostin gehört die arterielle Hypotonie. In einer Studie mit hochdosiertem Amifostin (910 mg/m²) bei Ovarialkarzinom wurde eine vorübergehende Hypotonie bei 62 % der Patienten beobachtet. Die Hypotonie begann im Mittel 14 Minuten nach dem Start der 15-minütigen Infusion und dauerte im Durchschnitt 6 Minuten an. In einigen Fällen führte dies zum Abbruch der Infusion. In allen Fällen kam der Blutdruck nach 5 bis 15 Minuten wieder auf normale Werte. Weniger als 3 % der Patienten brachen wegen dieser Nebenwirkung die supportive Behandlung mit Amifostin ab. In einer Studie mit Patienten mit Kopf-Hals-Karzinomen betrug die Amifostin-Dosis 200 mg/m², die vor einer Radiatio verabreicht wurden. In dieser Studie wurde die Hypotonie bei 15 % der Patienten beobachtet.[29]
Übelkeit und Erbrechen gehört ebenfalls zu den häufigeren Nebenwirkungen, bei etwa 10 % der Patienten. Hypokalzämie ist gelegentlich, bei etwa 1 % aller Patienten, zu beobachten. Selten sind die meist als Ausprägung einer Arzneimittelallergie auftretenden Nebenwirkungen wie Stevens-Johnson-Syndrom, Lyell-Syndrom (toxische epidermale Nekrolyse), Erythrodermie als Folge eines Arzneimittelexanthem, Fieber, Schüttelfrost, Niesen, Somnolenz und Schluckauf und Anaphylaxie. Das Bewusstsein wird nur selten verloren.[29]
Gegenanzeigen (Kontraindikationen)
Patienten mit arterieller Hypotonie sollten kein Amifostin erhalten, ebenso Patienten mit allergischen Reaktionen auf Amifostin.[29]
Entwicklungsgeschichte
1948 machte ein Arbeitsgruppe um den US-amerikanischen Radiologen Harvey Milton Patt (1918–1982)[31] die Entdeckung, dass die Aminosäure Cystein eine radioprotektive Wirkung[32] hat.[33] Dies war die Basis für die Entwicklung von WR-2721. Später wurde dann die Theorie aufgestellt, dass der Wirkmechanismus im Wesentlichen von der Thiol-Gruppe bestimmt wird, die sowohl freie Radikale als auch verschiedene Alkylantien binden kann.[34][35] WR-2721 wurde gegen Ende der 1950er Jahre am Walter-Reed-Militärkrankenhaus im Rahmen eines geheimen Forschungsprojektes der US Army entwickelt (U.S. Army Anti-Radiation Drug Development Program).[11][36] Daher auch der Code WR-2721 für Walter Reed 2721. Ziel des Projektes war die Entwicklung eines Radioprotektors zum Schutz von Soldaten in einem Atomkrieg. WR-2721 zeigte in einem Screening von über 4400 untersuchten Substanzen die höchste radioprotektive Wirkung, bei gleichzeitig hoher therapeutischer Breite und guter Verträglichkeit.[37][38][39][9] WR-2721 wurde nach seiner Entwicklung nicht für den ursprünglich vorgesehenen Zweck eingesetzt. Der Hauptgrund dafür war, dass WR-2721 nicht oral verfügbar ist und deshalb von den Soldaten selbst intravenös hätte appliziert werden müssen.[33]
Weiterführende Literatur
- Amifostin zur Zytoprotektion gegen Nebenwirkungen der Kombinationstherapie mit Cyclophosphamid und Cisplatin bei Patientinnen mit Ovarialkarzinom. In: Der Arzneimittelbrief Band 31, 1997, 6b
- F. A. Mettler, D. Brenner, C. N. Coleman, J. M. Kaminski, A. R. Kennedy, L. K. Wagner: Can radiation risks to patients be reduced without reducing radiation exposure? The status of chemical radioprotectants. In: AJR. American journal of roentgenology Band 196, Nummer 3, März 2011, S. 616–618, ISSN 1546-3141. doi:10.2214/AJR.10.4959. PMID 21343505. (Review).
- L. G. Marcu: The role of amifostine in the treatment of head and neck cancer with cisplatin-radiotherapy. In: European journal of cancer care Band 18, Nummer 2, März 2009, S. 116–123, ISSN 1365-2354. doi:10.1111/j.1365-2354.2008.01032.x. PMID 19267726. (Review).
- L. K. Mell, B. Movsas: Pharmacologic normal tissue protection in clinical radiation oncology: focus on amifostine. In: Expert opinion on drug metabolism & toxicology Band 4, Nummer 10, Oktober 2008, S. 1341–1350, ISSN 1742-5255. doi:10.1517/17425255.4.10.1341. PMID 18798703. (Review).
- N. P. Praetorius, T. K. Mandal: Alternate delivery route for amifostine as a radio-/chemo-protecting agent. In: The Journal of pharmacy and pharmacology Band 60, Nummer 7, Juli 2008, S. 809–815, ISSN 0022-3573. doi:10.1211/jpp.60.7.0001. PMID 18549666. (Review).
- M. I. Koukourakis, E. Maltezos: Amifostine administration during radiotherapy for cancer patients with genetic, autoimmune, metabolic and other diseases. In: Anti-cancer drugs Band 17, Nummer 2, Februar 2006, S. 133–138, ISSN 0959-4973. PMID 16428930. (Review).
- A. C. Müller: Wertigkeit des Comet Assays zur Detektion von Radioprotektion. Dissertation, Martin-Luther-Universität Halle-Wittenberg, 2003
- V. Santini: Amifostine: chemotherapeutic and radiotherapeutic protective effects. In: Expert opinion on pharmacotherapy Band 2, Nummer 3, März 2001, S. 479–489, ISSN 1465-6566. doi:10.1517/14656566.2.3.479. PMID 11336600. (Review).
- E. Halpick: Untersuchungen zur Wirkung von Amifostin (=WR (Walter Reed)-2721; S-2(3-Aminopropylamino)-Ethylphosphorothioat) auf die klonogene Proliferation frisch explantierter humaner Tumorzellen in vitro. Dissertation, FU Berlin, 1998
- J. L. Mitchell, J. Rupert, A. Leyser, G. G. Judd: Mammalian cell polyamine homeostasis is altered by the radioprotector WR1065. In: The Biochemical journal Band 335, Oktober 1998, S. 329–334, ISSN 0264-6021. PMID 9761731. PMC 1219786.
- M. Treskes, U. Holwerda, I. Klein, H. M. Pinedo, W. J. van der Vijgh: The chemical reactivity of the modulating agent WR2721 (ethiofos) and its main metabolites with the antitumor agents cisplatin and carboplatin. In: Biochemical pharmacology Band 42, Nummer 11, November 1991, S. 2125–2130, ISSN 0006-2952. PMID 1659819.
Einzelnachweise
- ↑ a b c d U. Holzgrabe, H. Szelényi: Amifostin Monohydrat. In: F. von Bruchhausen, S. Ebel, E. Hackenthal, U. Holzgrabe (Hrsg.): Hagers Handbuch der Pharmazeutischen Praxis. 5. Ausgabe, Verlag Springer, 1999, ISBN 3540626441, S. 61–62. Eingeschränkte Vorschau in der Google Buchsuche
- ↑ a b c Datenblatt Amifostine bei Sigma-Aldrich, abgerufen am 28. April 2011.
- ↑ a b c d e f g h i MSDS: Amifostine März 2004
- ↑ a b C. R. Culy, C. M. Spencer: Amifostine: an update on its clinical status as a cytoprotectant in patients with cancer receiving chemotherapy or radiotherapy and its potential therapeutic application in myelodysplastic syndrome. In: Drugs Band 61, Nummer 5, 2001, S. 641–684, ISSN 0012-6667. PMID 11368288. (Review).
- ↑ a b C. M. Spencer, K. L. Goa: Amifostine. A review of its pharmacodynamic and pharmacokinetic properties, and therapeutic potential as a radioprotector and cytotoxic chemoprotector. In: Drugs Band 50, Nummer 6, Dezember 1995, S. 1001–1031, ISSN 0012-6667. PMID 8612469. (Review).
- ↑ P. M. Calabro-Jones, J. A. Aguilera, J. F. Ward, G. D. Smoluk, R. C. Fahey: Uptake of WR-2721 derivatives by cells in culture: identification of the transported form of the drug. In: Cancer research Band 48, Nummer 13, Juli 1988, S. 3634–3640, ISSN 0008-5472. PMID 2837319.
- ↑ G. D. Smoluk, R. C. Fahey, P. M. Calabro-Jones, J. A. Aguilera, J. F. Ward: Radioprotection of cells in culture by WR-2721 and derivatives: form of the drug responsible for protection. In: Cancer research Band 48, Nummer 13, Juli 1988, S. 3641–3647, ISSN 0008-5472. PMID 2837320.
- ↑ P. M. Calabro-Jones, R. C. Fahey, G. D. Smoluk, J. F. Ward: Alkaline phosphatase promotes radioprotection and accumulation of WR-1065 in V79-171 cells incubated in medium containing WR-2721. In: International journal of radiation biology and related studies in physics, chemistry, and medicine Band 47, Nummer 1, Januar 1985, S. 23–27, ISSN 0020-7616. PMID 2982751.
- ↑ a b c d e f g h i j k l D. W. Wilder: Amifostin in subkutaner Anwendung bei Patienten mit Kopf-Hals-Tumoren. Dissertation, Universität Tübingen, 2006
- ↑ D. Citrin, A. P. Cotrim, F. Hyodo, B. J. Baum, M. C. Krishna, J. B. Mitchell: Radioprotectors and mitigators of radiation-induced normal tissue injury. In: The oncologist Band 15, Nummer 4, 2010, S. 360–371, ISSN 1549-490X. doi:10.1634/theoncologist.2009-S104. PMID 20413641. PMC 3076305. (Review).
- ↑ a b c d e J. R. Kouvaris, V. E. Kouloulias, L. J. Vlahos: Amifostine: the first selective-target and broad-spectrum radioprotector. In: The oncologist Band 12, Nummer 6, Juni 2007, S. 738–747, ISSN 1083-7159. doi:10.1634/theoncologist.12-6-738. PMID 17602063. (Review).
- ↑ J. D. Cox, K. K. Ang: Radiation oncology - rationale, technique, results. Verlag Elsevier Health Sciences, 2003, ISBN 0-323-01258-2, S. 42.Eingeschränkte Vorschau in der Google Buchsuche nach: J. M. Yuhas, J. M. Spellmann, F. Culo: The role of WR-2721 in radiotherapy and/or chemotherapy. In: L. W. Brady (Hrsg.): Radiation Sensitizers.' Verlag Masson, 1980
- ↑ a b c M. I. Koukourakis: Amifostine in clinical oncology: current use and future applications. In: Anti-cancer drugs Band 13, Nummer 3, März 2002, S. 181–209, ISSN 0959-4973. PMID 11984063. (Review).
- ↑ M. I. Koukourakis: Amifostine: is there evidence of tumor protection? In: Seminars in oncology Band 30, Nummer 6 Suppl 18, Dezember 2003, S. 18–30, ISSN 0093-7754. PMID 14727237. (Review).
- ↑ A. D. Sasse, L. G. Clark, E. C. Sasse, O. A. Clark: Amifostine reduces side effects and improves complete response rate during radiotherapy: results of a meta-analysis. In: International journal of radiation oncology, biology, physics Band 64, Nummer 3, März 2006, S. 784–791, ISSN 0360-3016. doi:10.1016/j.ijrobp.2005.06.023. PMID 16198504. (Review).
- ↑ a b J. M. Yuhas, J. M. Spellman, F. Culo: The role of WR-2721 in radiotherapy and/or chemotherapy. In: Cancer clinical trials Band 3, Nummer 3, 1980, S. 211–216, ISSN 0190-1206. PMID 6254681.
- ↑ W. J. DeNeve, C. K. Everett, J. E. Suminski, F. A. Valeriote: Influence of WR2721 on DNA cross-linking by nitrogen mustard in normal mouse bone marrow and leukemia cells in vivo. In: Cancer research Band 48, Nummer 21, November 1988, S. 6002–6005, ISSN 0008-5472. PMID 2844397.
- ↑ a b M. Treskes, L. G. Nijtmans, A. M. Fichtinger-Schepman, W. J. van der Vijgh: Effects of the modulating agent WR2721 and its main metabolites on the formation and stability of cisplatin-DNA adducts in vitro in comparison to the effects of thiosulphate and diethyldithiocarbamate. In: Biochemical pharmacology Band 43, Nummer 5, März 1992, S. 1013–1019, ISSN 0006-2952. PMID 1313234.
- ↑ a b c R. L. Capizzi: The preclinical basis for broad-spectrum selective cytoprotection of normal tissues from cytotoxic therapies by amifostine. In: Seminars in oncology Band 26, Nummer 2 Suppl 7, April 1999, S. 3–21, ISSN 0093-7754. PMID 10348255. (Review).
- ↑ L. M. Shaw, A. T. Turrisi, D. J. Glover, H. S. Bonner, A. L. Norfleet, C. Weiler, M. M. Kligerman: Human pharmacokinetics of WR-2721. In: International journal of radiation oncology, biology, physics Band 12, Nummer 8, August 1986, S. 1501–1504, ISSN 0360-3016. PMID 3019968.
- ↑ a b L. M. Shaw, D. Glover, A. Turrisi, D. Q. Brown, H. S. Bonner, A. L. Norfleet, C. Weiler, J. H. Glick, M. M. Kligerman: Pharmacokinetics of WR-2721. In: Pharmacology & therapeutics Band 39, Nummer 1-3, 1988, S. 195–201, ISSN 0163-7258. PMID 2849123. (Review).
- ↑ a b L. M. Shaw, H. S. Bonner, A. Turrisi, A. L. Norfleet, M. Kligermann: Measurement of S-2-(3-aminopropylamino)ethanethiol (WR-1065) in blood and tissues. In: J Liquid Chromatogr Band 9, Nummer 4, 1986, S. 845–859. doi:10.1080/01483918608076673
- ↑ J. M. Yuhas: Active versus passive absorption kinetics as the basis for selective protection of normal tissues by S-2-(3-aminopropylamino)-ethylphosphorothioic acid. In: Cancer research Band 40, Nummer 5, Mai 1980, S. 1519–1524, ISSN 0008-5472. PMID 6245795.
- ↑ J. L. Millar, T. J. McElwain, R. D. Clutterbuck, E. A. Wist: The modification of melphalan toxicity in tumor bearing mice by s-2-(3-aminopropylamino)- ethylphosphorothioic acid (WR 2721). In: American journal of clinical oncology Band 5, Nummer 3, Juni 1982, S. 321–328, ISSN 0277-3732. PMID 6282111.
- ↑ L. C. Washburn, J. J. Rafter, R. L. Hayes: Prediction of the effective radioprotective dose of WR-2721 in humans through an interspecies tissue distribution study. In: Radiation research Band 66, Nummer 1, April 1976, S. 100–105, ISSN 0033-7587. PMID 1257403.
- ↑ Radioprotektor als Bolus applizieren. Praxis-Depesche 15, 1999, nach: W. Wagner, A. Radmard, G. Mansour, K. Schonekas, S. Zaknoen: Improved Feasibility of Amifostine Application in Radiotherapy by Using a New Administration Schedule (Meeting abstract). In: 1999 ASCO Annual Meeting Meeting Abstract #2348
- ↑ J. Langell, R. Jennings, J. Clark, J. B. Ward: Pharmacological agents for the prevention and treatment of toxic radiation exposure in spaceflight. In: Aviation, space, and environmental medicine Band 79, Nummer 7, Juli 2008, S. 651–660, ISSN 0095-6562. PMID 18619123. (Review).
- ↑ R. Cosar, V. Yurut-Caloglu, S. Eskiocak, A. Ozen, S. Altaner, K. Ibis, N. Turan, B. Denizli, C. Uzal, M. Saynak, S. Parlar, M. Caloglu, B. Uregen, Z. Kocak: Radiation-induced chronic oxidative renal damage can be reduced by amifostine. In: Medical oncology (Northwood, London, England) [elektronische Veröffentlichung vor dem Druck] Februar 2011, ISSN 1559-131X. doi:10.1007/s12032-011-9870-7. PMID 21347716.
- ↑ a b c Ethyol bei RxList.com, vom 18. August 2008
- ↑ J. R. Piper, C. R. Stringfellow, R. D. Elliott, T. P. Johnston: S-2-(omega-aminoalkylamino)ethyl dihydrogen phosphorothioates and related compounds as potential antiradiation agents. In: Journal of medicinal chemistry Band 12, Nummer 2, März 1969, S. 236–243, ISSN 0022-2623. PMID 5783596.
- ↑ S. Wolff: Harvey Milton Patt, Radiology; Physiology: San Francisco. Abgerufen am 29. April 2011
- ↑ H. M. Patt, E. B. Tyree, R. L. Straube, D. E. Smith: Cysteine Protection against X Irradiation. In: Science (New York, N.Y.) Band 110, Nummer 2852, August 1949, S. 213–214, ISSN 0036-8075. doi:10.1126/science.110.2852.213. PMID 17811258.
- ↑ a b W. McCulloch, B. Scheffler, P. Schein: WR-2721 (ETHYOL): Reduction in Toxicity of Anticancer Therapy Without Loss of Efficacy. S. B. Howell (Hrsg.): Platinum and other metal coordination compounds in cancer chemotherapy. Verlag Springer, 1991, ISBN 0-306-44027-X, S. 509–516 Eingeschränkte Vorschau in der Google Buchsuche
- ↑ P. Alexander, Z. M. Bacq, S. F. Cousens, M. Fox, A. Herve, J. Lazar: Mode of action of some substances which protect against the lethal effects of x-rays. In: Radiation research Band 2, Nummer 4, Juni 1955, S. 392–415, ISSN 0033-7587. PMID 14385034.
- ↑ Z. M. Bacq, P. Alexander: Importance for radio-protection of the reaction of cell to sulphydyrl and disulphide compounds. In: Nature Band 203, Juli 1964, S. 162–164, ISSN 0028-0836. PMID 14207236.
- ↑ J. M. Yuhas, J. B. Storer: Differential chemoprotection of normal and malignant tissues. In: Journal of the National Cancer Institute Band 42, Nummer 2, Februar 1969, S. 331–335, ISSN 0027-8874. PMID 5765464.
- ↑ R. L. Capizzi: Clinical status and optimal use of amifostine. In: Oncology Band 13, Nummer 1, Januar 1999, S. 47–59, ISSN 0890-9091. PMID 10027198. (Review).
- ↑ D. J. Grdina, Y. Kataoka, J. S. Murley: Amifostine: mechanisms of action underlying cytoprotection and chemoprevention. In: Drug metabolism and drug interactions Band 16, Nummer 4, 2000, S. 237–279, ISSN 0792-5077. PMID 11201306.
- ↑ D. E. Davidson, M. M. Grenan, T. R. Sweeney: Biological characteristics of some improved radioprotectors. In: L. W. Brady (Herausgeber): Radiation Sensitizers, Their use in the Clinical Management of Cancer. Band 5 von Cancer Management Masson, 1980, ISBN 0-893-52112-4, S. 309–320.
Weblinks
- Ethyol bei rxlist.com (englisch)
- Amifostine bei drugs.com (englisch)

Bitte den Hinweis zu Gesundheitsthemen beachten!
Wikimedia Foundation.


