- Peptidbindung
-
Eine Peptidbindung ist eine amidartige Bindung zwischen der Carboxygruppe einer Aminosäure und der Aminogruppe einer zweiten Aminosäure. Zwei Aminosäuren können (formal) unter Wasserabspaltung zu einem Dipeptid kondensieren. Bei der Translation wird diese Reaktion von den Ribosomen katalysiert.
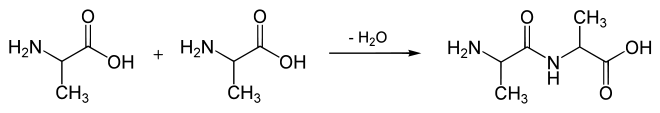
Formal reagieren zwei Moleküle der proteinogenen Aminosäure Alanin unter Wasserabspaltung zu dem Dipeptid Alanyl-Alanin:
Da die Aminogruppe zu schwach nukleophil ist, um direkt mit der Carboxygruppe ein Amid zu liefern, liegt das Gleichgewicht unter Normbedingungen ganz auf der linken Seite, d. h. das Dipeptid bildet sich nicht spontan und die chemische Reaktion ist endergonisch.
Sowohl bei der Laborsynthese von Peptiden als auch bei der biologischen Synthese von Peptiden und Proteinen müssen die reaktiven Gruppen zuerst aktiviert werden. Dies geschieht durch vorherige Umwandlung in reaktionsfähigere Verbindungen.
Durch mehrfache Kondensation bilden sich Tripeptide, Tetrapeptide, Polypeptide und schließlich Proteine, kettenförmige, aus Aminosäuren aufgebaute Makromoleküle. Polypeptidketten (bzw. Proteinketten) bilden das primäre Strukturelement der Proteine.
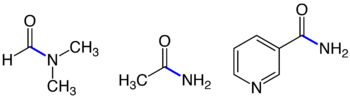 Drei Amide mit jeweils blau markierter Amidbindung: Dimethylformamid (DMF, links), Acetamid (Mitte) und Nicotinamid (rechts).
Drei Amide mit jeweils blau markierter Amidbindung: Dimethylformamid (DMF, links), Acetamid (Mitte) und Nicotinamid (rechts).
 Mesomere Grenzstrukturen einer trans-Peptidbindung. (Wenn das Proton am positiv geladenen Stickstoffatom zum negativ geladenen Sauerstoffatom gewandert ist, liegt eine Amid-Aminol-Tautomerie vor.)
Mesomere Grenzstrukturen einer trans-Peptidbindung. (Wenn das Proton am positiv geladenen Stickstoffatom zum negativ geladenen Sauerstoffatom gewandert ist, liegt eine Amid-Aminol-Tautomerie vor.)
Die Röntgenanalyse von Aminosäuren und Dipeptiden zeigt, dass die Amid-Gruppe planar gebaut ist, d. h. alle am Aufbau der Verbindung beteiligten Atome liegen in einer Ebene. Der Diederwinkel (HNCO) liegt daher bei 180° und die Atome können wegen Mesomeriestabilisierung nicht gegeneinander verdreht werden. In den nativen Proteinen liegen vorwiegend trans-Peptidbindungen vor, cis-Peptidbindungen finden sich vor allem in cyclischen Dipeptiden (Diketopiperazinen) und cyclischen Tripeptiden (Beispiel: Cyclotriprolyl).[1]
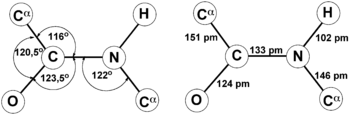 Bindungswinkel (links) und Bindungslängen (rechts) einer typischen trans-Peptidbindung.[1]
Bindungswinkel (links) und Bindungslängen (rechts) einer typischen trans-Peptidbindung.[1]
Die Bindungslängen sind zwischen Stickstoff und Carbonyl-Kohlenstoff 133 pm, zwischen Stickstoff und Seitenketten-Kohlenstoff 146 pm, zwischen Carbonyl-Kohlenstoff und Seitenketten-Kohlenstoff 151 pm und zwischen Carbonyl-Kohlenstoff und Sauerstoff 124 pm.[1] Die geringere Länge der C-N-Bindung in der Amidbindung im Vergleich zur normalen C-N-Bindung weist darauf hin, dass sie Doppelbindungscharakter besitzt; diese Art der chemischen Bindung wird auch partielle Doppelbindung genannt. Diese Besonderheit findet ihre Erklärung in der Amid-Aminol-Tautomerie der Peptidbindung.
Peptide vs. Amide
Durch die „formale“ Reaktion der Carboxygruppe einer Aminosäure und der Aminogruppe einer zweiten Aminosäure bildet sich unter Wasserabspaltung eine Peptidbindung. Diese Peptidbindung ist der Sonderfall einer Amidbindung. Jede derartige Peptidbindung ist zugleich auch eine Amidbindung. Andererseits führt die „formale“ Reaktion der Carboxygruppe einer beliebigen Carbonsäure und der Aminogruppe eines primären oder sekundären Amins unter Wasserabspaltung zur Bildung einer Amidbindung jedoch nicht zu einer Peptidbindung. Nur zwischen zwei oder mehr Aminosäuren können sich durch „formale“ Wasserabspaltung Peptide mit einer oder mehreren Peptidbindungen bilden.
Einzelnachweise
- ↑ a b c Hans-Dieter Jakubke und Hans Jeschkeit: Aminosäuren, Peptide, Proteine, Verlag Chemie, Weinheim (1982), ISBN 3-527-25892-2.
Wikimedia Foundation.