- Ribosom
-
Ribosomen sind makromolekulare Komplexe aus Proteinen und Ribonukleinsäuren (RNA), die im Cytoplasma, in den Mitochondrien und in den Chloroplasten vorkommen. An ihnen werden Proteine hergestellt, und zwar entsprechend der Basensequenz der DNA, die die Information zur Aminosäuresequenz der Proteine enthält. Hier werden die einzelnen Aminosäuren in genau der Reihenfolge, die das jeweilige Gen vorschreibt, zu einem Kettenmolekül zusammengesetzt. Die Information zur Aminosäuresequenz in der DNA wird durch Boten-RNA (mRNA) vermittelt. Die Umwandlung der in der mRNA gespeicherten Information in eine Abfolge von verknüpften Aminosäuren wird als Translation (lat. für Übersetzung) bezeichnet. Die Translation der mRNA am Ribosom ist ein zentraler Bestandteil der Proteinbiosynthese und kommt in allen Lebewesen vor.
Inhaltsverzeichnis
Aufbau und Arten
Ribosomen sind granuläre Partikel mit einem Durchmesser von etwa 20 - 25 nm. Sie bestehen zu etwa zwei Dritteln aus RNA (rRNA) und einem Drittel aus ribosomalen Proteinen. Sie setzen sich in allen Organismen aus zwei unterschiedlich großen und funktionell verschiedenen Untereinheiten zusammen. Die Masse der Ribosomen wird durch ihr Sedimentationsverhalten charakterisiert, das in Svedberg-Einheiten (S) angegeben wird. Während der Translation assemblieren sie zu einem funktionalen Komplex, wobei die große Untereinheit in der Proteinbiosynthese die Aminosäuren zur Kette verknüpft (Peptidyltransferaseaktivität), und die kleine Untereinheit für die mRNA-Erkennung verantwortlich ist. Beide Untereinheiten bestehen aus Proteinen und rRNA, wobei die Proteine für den Zusammenhalt und die richtige Positionierung zuständig sind, die eigentlichen Reaktionen hingegen werden durch die rRNAs vorgenommen. Beide Untereinheiten werden bei Eukaryonten in den Nucleoli innerhalb der Zellkerne gebildet und werden dann durch die Kernporen ins Cytoplasma geleitet.
Prokaryotische Ribosomen
prokaryotische Ribosomen (E. coli)[1] Ribosom Untereinheit rRNAs Proteine 70S 50S 23S (2904 nt) 31 5S (120 nt) 30S 16S (1542 nt) 21 Die Anzahl von Ribosomen je Zelle liegt bei Prokaryoten in der Größenordnung von 10.000, beispielsweise besitzt ein einzelnes E. coli-Bakterium etwa 20.000 Ribosomen.[1] Die Ribosomen haben einen Sedimentationskoeffizienten von 70S und eine molare Masse von etwa 2,5 MDa. Bei Magnesiumkonzentrationen unter 1 mmol/L zerfällt das 70S-Ribosom zu einer 50S- und einer kleineren 30S-Untereinheit. Die 30S-Untereinheit (0,9 MDa) ist aus 21 verschiedenen ribosomalen Proteinen und einer 16S ribosomalen RNA (16S rRNA) zusammengesetzt. In der 50S-Untereinheit (1,6 MDa) finden sich 31 verschiedene Proteine sowie zwei rRNAs (23S und 5S rRNA).
Die Proteine der kleinen Untereinheit werden mit „S“ (engl. small „klein“), die der großen Untereinheit mit „L“ (engl. large „groß“) gekennzeichnet. Ihre Aminosäuresequenzen besitzen keine besonderen Gemeinsamkeiten, sind aber reich an positiv geladenen Aminosäuren wie L-Lysin oder L-Arginin. Dies erlaubt eine bessere Interaktion mit den negativ geladenen rRNAs. Das größte bakterielle, ribosomale Protein ist S1 mit 61,2 kDa und 557 Aminosäuren), das kleinste ist L34 mit 5,4 kDa und 34 Aminosäuren.
Eukaryotische Ribosomen
eukaryotische cytosolische Ribosomen (R. norvegicus)[2] Ribosom Untereinheit rRNAs Proteine 80S 60S 28S (4718 nt) 49 5,8S (160 nt) 5S (120 nt) 40S 18S (1874 nt) 33 In eukaryotischen Zellen kommen Ribosomen nicht nur im Cytoplasma, sondern auch in den Mitochondrien oder - bei Pflanzen - auch zusätzlich in den Chloroplasten vor. Man schätzt die Zahl cytosolischer Ribosomen je Zelle auf zwischen 105 und über 107, womit eukaryotische Zellen mehr Ribosomen besitzen als prokaryotische. Die Anzahl ist vom Zelltyp abhängig, und zwar von der Proteinsyntheserate der Zelle. So ist die Ribosomenanzahl in Leberzellen besonders hoch. Außerdem sind eukaryotische Ribosomen des Cytosols auch größer, sie haben einen Durchmesser von etwa 25 nm.[3] Diese haben eine molare Masse von etwa 4,2 MDa, der Sedimentationskoeffizient beträgt 80S. Bei der großen Untereinheit liegt er bei 60S (2,8 MDa) und bei seiner kleinen Untereinheit bei 40S (1,4 MDa).[4] Die kleine Untereinheit besteht in Säugern aus 33 Proteinen und einer rRNA (18S rRNA), die große Untereinheit aus 49 Proteinen und drei rRNAs (28S, 5,8S und 5S). Cytosolische Ribosomen höherer Eukaryoten sind komplexer als die niederer Eukaryoten. So ist die 28S rRNA in Backhefe 3392 Nukleotide lang, in Säugern wie der Ratte dagegen 4718 Nukleotide. Auch die 18S rRNA ist in Backhefe kleiner als in der Ratte (1799 gegenüber 1874 Nukleotide).
Die eigentliche katalytische Funktion besitzt die rRNA, wohingegen die Proteine eher am Rand des Ribosoms sitzen. In Eukaryoten gibt es außer den freien cytoplasmatischen Ribosomen auch membrangebundene Ribosomen, die an die Membran des rauen endoplasmatischen Retikulums (ER) gebunden sind (s. u.). Die Bildung der ribosomalen Untereinheiten findet im Nucleolus statt. Zellen mit hoher Proteinsyntheserate haben deshalb besonders gut ausgeprägte Nucleoli. Freie und membrangebundene Ribosomen haben die gleiche Struktur und können zwischen den Funktionen wechseln.
Die Ribosomen aus Mitochondrien und Chloroplasten sind den prokaryotischen Ribosomen ähnlich, was die Endosymbiontenhypothese stützt.
Die Schreibweise eukaryotischer ribosomaler Proteine ist nicht ganz einheitlich. In Backhefe werden Proteine der großen Untereinheit mit „Rpl“, die der kleinen mit „Rps“ bezeichnet. Bei den entsprechenden Proteinen der Säuger verwendet man auch die Großschreibung RPL bzw. RPS.
Freie und membrangebundene Ribosomen
Ribosomen können in eukaryotischen Zellen nach dem Ort ihrer Synthesetätigkeit unterschieden werden. Freie Ribosomen liegen im Cytoplasma verstreut und erzeugen Proteine, die ihre Aufgabe meistens ebenfalls im Zellplasma wahrnehmen. Membrangebundene Ribosomen sind mit der Membran des endoplasmatischen Retikulums verbunden. Die dort synthetisierten Proteine werden mittels des cotranslationalen Proteintransportes in das Lumen des endoplasmatischen Reticulums geleitet. Membrangebundene Ribosomen findet man gehäuft in sekretbildenden Zellen wie z. B. in der Bauchspeicheldrüse.
Funktionsweise
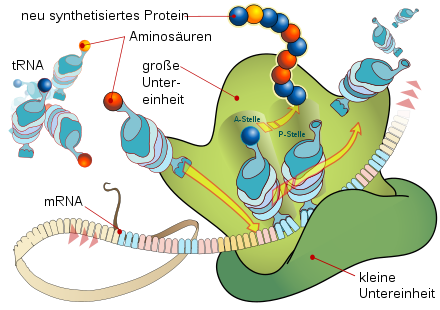 Translation an einem Ribosom
Translation an einem Ribosom
Die Funktionsweise des Ribosoms während der Translation kann durch das Dreistellenmodell charakterisiert werden. Demnach besitzt das Ribosom drei tRNA-Bindungsstellen, die A-(Aminoacyl-), P-(Peptidyl-) und E-(Exit-)Stelle. Während des Elongationszyklus oszilliert das Ribosom zwischen zwei Zuständen, dem prä- und dem post-translationalen Zustand, wobei zwei der drei tRNA-Bindungsstellen mit einer tRNA besetzt sind. Im prätranslationalen Zustand sind die A- und P-Stelle besetzt, wobei die P-Stelle die tRNA mit der Polypeptidkette trägt und die A-Stelle von der neu hinzugekommenen Aminoacyl-tRNA besetzt ist. Im Ribosom wird nun die Polypeptidkette von der P-Stellen-tRNA auf die A-Stellen-tRNA übertragen. Danach wechselt das Ribosom in den posttranslationalen Zustand und wandert um drei Basen auf der mRNA weiter, wodurch die vorherige A-Stellen-tRNA zur P-Stellen-tRNA wird und die nun leere ehemalige P-Stellen-tRNA über die E-Stelle (Exit) aus dem Ribosom geschleust wird.
Die beiden Hauptzustände des Ribosoms (prä- und posttranslational) sind durch eine hohe Aktivierungsenergie-Barriere voneinander getrennt. Die zentrale Rolle der beiden Elongationsfaktoren besteht darin, diese Energiebarriere zu erniedrigen und so das Ribosom in den jeweils anderen Zustand zu versetzen.
Häufig formieren sich mehrere prokaryotische Ribosomen an demselben mRNA-Molekül perlschnurartig zu einem Polysom.
Nachdem ein Peptid im Ribosom verknüpft wurde, durchwandert es einen ribosomalen Tunnel. Dieser besteht größtenteils aus rRNA und tritt aus der großen ribosomalen Untereinheit aus. Er hat eine Länge von ca. 100 Å und einen durchschnittlichen Durchmesser von 15 Å. An dessen engster Stelle wird der Kanal durch zwei konservierte ribosomale Proteine begrenzt, L4e und L22.
Ribophagie
Der Abbau von Ribosomen ist noch nicht vollständig verstanden. Er wird in der Regel unter Nährstoffmangel eingeleitet. Für Bakterien wie E. coli wurde vorgeschlagen, dass intakte 70S-Ribosomen zunächst in beide Untereinheiten zerfallen.[5] Unter Mangelbedindungen wird die Translation in der Zelle heruntergefahren, so dass viele Ribosomen inaktiv sind. Die beiden Untereinheiten sind wesentlich empfindlicher gegenüber Ribonukleasen (RNasen) als ein intaktes Ribosom, da sie eine größere Angriffsfläche bieten. Danach könnten auch Exonukleasen die ribosmale RNA weiter abbauen.
Für Backhefe, ein Eukaryot, wurde ein mit „Ribophagie“ bezeichneter Autophagieweg vorgeschlagen.[6] Dieser lehnt die Begriffe Mitophagie (Abbau von Mitochondrien)[7], Pexophagie (Abbau von Peroxisomen)[8] und Reticulophagie (Abbau des endoplasmatischen Retikulums)[9] an. Unter Nährstoffmangel baut Hefe Ribosomen ab, der ähnlich wie bei Prokaryoten beginnt. Zunächst werden die beiden Untereinheiten getrennt. Eine Ubiquitinligase entfernt dann Ubiquitin an der 60S-Untereinheit, welche dann in einem Vesikel zur Vakuole transportiert wird. Dies erscheint zunächst paradox, da Ubiquitin ein allgemeines Abbausignal für die meisten Proteine ist. Von den Autoren wurde vorgeschlagen, dass eine Ubiquitinligase die 60S-Untereinheit zunächst für den Abbauweg markiert, der Prozess aber erst durch die Ubiquitinprotease endgültig ablaufen kann.
Strukturaufklärung
Ribosomen wurden durch den Forscher Albert Claude Mitte des 20. Jahrhunderts entdeckt.[10][11] 1940 hatte er mit Hilfe der Dunkelfeldmikroskopie RNA-enthaltende Granula aus dem Cytosol tierischer Zellen identifiziert, die kleiner als Mitochondrien waren.[12] Er bezeichnete diese als „Mikrosomen“, spätere Analysen zeigten, dass sie Komplexe aus Phospholipiden und Ribonukleinproteinen waren. Heutzutage werden Fragmente des ERs als Mikrosomen bezeichnet. Durch Fortschritte in der Elektronenmikroskopie gelang es 1955 George Emil Palade, jene „Mikrosomen“ eindeutig als Bestandteile einer Zelle und nicht bloß als Artefakte von Zelltrümmern zu identifizieren.[13] Es gab immer mehr Hinweise darauf, dass diese Ribonukleinproteinpartikel etwas mit der Translation zu tun hatten. 1959, wurde auch der Beweis in E. coli erbracht, dass Ribosomen für die Biosynthese von Polypeptide notwendig sind.[14]
1958 griff Richard B. Roberts in einem Symposium den Vorschlag auf, den Namen „Mikrosom“ bzw. „mikrosome Partikel“ auf den besserklingenden und einfachen Namen − so Roberts − „Ribosom“ zu ändern.[15] Diese Abkürzung verweist auf die Art der Partikel, Komplexe aus RNA und Proteinen (Ribonukleopartikel). Die Bezeichnung „Ribosom“ konnte sich durchsetzen und wird im Sprachgebrauch verwendet.
Wegen ihrer Größe konnten erst in jüngerer Zeit hochauflösende Strukturen von Ribosomen gewonnen werden, wenngleich der grobe molekulare Aufbau seit den 1970er-Jahren bekannt ist. Einige Details ribosomaler Proteine konnten mittels Affinitätsmarkierung und chemisches Quervernetzen (crosslinking) aufgeklärt werden.[16] Ende 2000 wurde zum ersten Mal die 50S-Untereinheit des Archaeon Haloarcula marismortui in einer Auflösung von 2,4 Å aufgeklärt.[17] In dieser Auflösung kann man einzelne Moleküle auflösen. Zeitgleich wurde auch die Strukturen der kleinen ribosomalen Untereinheit aus Thermus thermophilus in einer atomaren Auflösung von 3 Å publiziert.[18][19] Da zu diesem Zeitpunkt keine Strukturdaten des kompletten Ribosoms vorlagen, wurden die vorhandenen Daten genutzt, um das prokaryotische Ribosom zu rekonstruieren.[20]
2005 wurden zum ersten Mal die kristallographischen Strukturdaten eines intakten Ribosom aus E. coli in einer Auflösung von 3,5 Å vorgestellt.[21]. Nahezu zeitgleich konnte eine andere Forschergruppe eine Struktur präsentieren, die mit Hilfe der Cryoelektronenmikroskopie gewonnen wurde.[22] Die Auflösung war mit über 10 Å vergleichsweise gering, zeigte aber eine Momentanaufnahme der Translation am Translokon.
Später wurden immer mehr Strukturdaten von (prokaryotischen) Ribosomen veröffentlicht, die gerade mRNAs oder tRNAs gebunden hatten und damit einen besseren Einblick auf die Prozesse der Translation gewährten.[23][24]
Für das eukaryotische Ribosom (80S) gibt es noch keine vergleichbaren Strukturdaten. Eine dreidimensionale Rekonstruktion ist indes aus den gesammelten Daten der Kryoelektronenmikroskopie, der Röntgenkristallographie einzelner ribosomalen Komponenten sowie Homologievergleiche mit prokaryontischen Ribosomen möglich.[25][26][27]
Thomas A. Steitz, Ada Yonath und Venkatraman Ramakrishnan erhielten für ihre Arbeit an der Strukturaufklärung 2009 den Nobelpreis für Chemie.[28]
Literatur
- Donald Voet und Judith G. Voet: Biochemie. Wiley-VCH 1994; ISBN 3-527-29249-7; S. 917ff.
- Alexander S. Spirin: Ribosomes (Cellular Organelles). Springer, Berlin 1999; ISBN 0-306-46145-5
- Reginald Garrett und Charles M. Grisham: Biochemistry. (International Student Edition). Cengage Learning Services; 4. Auflage 2009; ISBN 978-0-495-11464-2
Einzelnachweise
- ↑ a b Reginald Garrett und Charles M. Grisham: Biochemistry. (International Student Edition). Cengage Learning Services; 4. Auflage 2009; ISBN 978-0-495-11464-2; S. 962
- ↑ Reginald Garrett und Charles M. Grisham: Biochemistry. (International Student Edition). Cengage Learning Services; 4. Auflage 2009; ISBN 978-0-495-11464-2; S. 965
- ↑ Helmut Plattner und Joachim Hentschel: Zellbiologie. Thieme, Stuttgart; 3., neu bearb. Auflage 2006; ISBN 3-13-106513-3; S. 181
- ↑ Reginald Garrett und Charles M. Grisham: Biochemistry. (International Student Edition). Cengage Learning Services; 4. Auflage 2009; ISBN 978-0-495-11464-2; S. 964
- ↑ Zundel, MA. et al. (2009): Initiation of ribosome degradation during starvation in Escherichia coli. In: RNA 15(5); 977–783; PMID 19324965; PDF (freier Volltextzugriff, engl.)
- ↑ Kraft, C. et al. (2008): Mature ribosomes are selectively degraded upon starvation by an autophagy pathway requiring the Ubp3p/Bre5p ubiquitin protease. In: Nat Cell Biol. 10(5); 602–610; PMID 18391941; doi:10.1038/ncb1723
- ↑ Kim, I. et al. (2007): Selective degradation of mitochondria by mitophagy. In: Arch Biochem Biophys. 462(2); 245–253; PMID 17475204; PDF (freier Volltextzugriff, engl.)
- ↑ Dunn, WA. Jr. et al. (2005): Pexophagy: the selective autophagy of peroxisomes. In: Autophagy 1(2); 75–83; PMID 16874024; PDF (freier Volltextzugriff, engl.)
- ↑ Klionsky, DJ. et al. (2007): How shall I eat thee? In: Autophagy 3(5); 413–416; PMID 17568180; PDF (freier Volltextzugriff, engl.)
- ↑ Donald Voet und Judith G. Voet: Biochemie. Wiley-VCH 1994; ISBN 3-527-29249-7; S. 917
- ↑ Alexander S. Spirin: Ribosomes (Cellular Organelles). Springer, Berlin 1999; ISBN 0-306-46145-5, S. 47
- ↑ Claude, A. (1940): Particulate components of normal and tumor cells. In: Science 91(2351); 77–78: PMID 17783332; doi:10.1126/science.91.2351.77
- ↑ Palade, GE. (1955): A small particulate component of the cytoplasm. In: J Biophys Biochem Cytol. 1(1); 59–68; PMID 14381428; PDF (freier Volltextzugriff, engl.)
- ↑ McQuillen, K., Roberts, RB. und Britten, RJ. (1959): SYNTHESIS OF NASCENT PROTEIN BY RIBOSOMES IN ESCHERICHIA COLI. In: Proc Natl Acad Sci USA 45(9):1437–1447; PMID 16590524; PDF (freier Volltextzugriff, engl.)
- ↑ Eichard B. Roberts: Microsomal Particles and Protein Synthesis. London, Pergamon Press 1958; Volltextzugriff, engl.
- ↑ Czernilofsky, AP., Kurland, CG. und Stöffler, G. (1975): 30S ribosomal proteins associated with the 3'-terminus of 16S RNA. In: FEBS Lett. 58(1); 281–284; PMID 1225593
- ↑ Ban, N. et al. (2000). The complete atomic structure of the large ribosomal subunit at 2.4 ångström resolution. In: Science 289 (5481); 905–920; PMID 10937989; doi:10.1126/science.289.5481.905
- ↑ Schluenzen, F. et al. (2000): Structure of functionally activated small ribosomal subunit at 3.3 angstroms resolution. In: Cell 102(5); 615–623; PMID 11007480
- ↑ Wimberly, BT., et al. (2000): Structure of the 30S ribosomal subunit. In: Nature. 407(6802); 327–339; PMID 11014182; doi:10.1038/35030006
- ↑ Yusupov, MM. et al. (2001): Crystal structure of the ribosome at 5.5 ångström resolution. In: Science. 292(5518); 883–896. PMID 11283358; doi:10.1126/science.1060089
- ↑ Schuwirth, B. S. et al. (2005): Structures of the bacterial ribosome at 3.5 A resolution. In: Science 310(5749): 827–834; PMID 16272117; doi:10.1126/science.1117230
- ↑ Mitra, K. et al. (2005): Structure of the E. coli protein-conducting channel bound to a translating ribosome. In: Nature. 438(7066); 318–324; PMID 16292303; PDF (freier Volltextzugriff, engl.)
- ↑ Selmer, M. et al (2006): Structure of the 70S ribosome complexed with mRNA and tRNA. In: Science 313(5795): 1935–1942; PMID 16959973
- ↑ Korostelev, A., Trakhanov, S., Laurberg, M. und Noller, H. F. (2006): Crystal structure of a 70S ribosome-tRNA complex reveals functional interactions and rearrangements. In: Cell 126(6); 1065–1077; PMID 16962654
- ↑ Gilbert, R. J. et al. (2004): Three-dimensional structures of translating ribosomes by Cryo-EM. In: Mol Cell 14(1): 57–66; PMID 15068803
- ↑ Stark, H. (2002): Three-dimensional electron cryomicroscopy of ribosomes. In: Curr Protein Pept Sci 3(1): 79–91; PMID 12370013
- ↑ Spahn, C. M., et al. (2001): Structure of the 80S ribosome from Saccharomyces cerevisiae--tRNA-ribosome and subunit-subunit interactions. In: Cell 107(3): 373–386; PMID 11701127
- ↑ Nobelpreis für Chemie 2009
Weblinks
- Proteopedia: Ribosome
- Ribosomal Database (Datenbank über ribosomale Proteine)
- Video: Erklärung der Ribosomstruktur und ihre Entdeckung
Kategorien:- Zellbestandteil
- RNA
- Proteinkomplex
Wikimedia Foundation.
