- Trypsin
-
Trypsin-1 —
Vorhandene Strukturdaten: 1fxy, 1trn, 2ra3 Masse/Länge Primärstruktur 224 Aminosäuren Kofaktor Ca2+ Isoformen einkettig / zweikettig Bezeichner Gen-Namen PRSS1; TRY1 Externe IDs OMIM: 276000 UniProt: P07477 Arzneistoffangaben ATC-Code B06AA07
D03BA01Enzymklassifikation EC, Kategorie 3.4.21.4 Serinprotease MEROPS S01.127 Reaktionsart Hydrolyse Substrat Arginin-, Lysin-Bindungen in Peptiden Produkte Spaltprodukte Vorkommen Übergeordnetes Taxon Eukaryoten Humanes Trypsin ist ein Gemisch dreier Verdauungsenzyme, die im Dünndarm Eiweiße zersetzen und zu den Peptidasen zählen: Trypsin-1 (kationisches Trypsin, zwei Drittel), Trypsin-2 (anionisches Trypsin, etwa ein Drittel) und Trypsin-4 (Mesotrypsin, wenige Prozent). Viele ähnliche Enzyme bei Säugetieren, Insekten, Fischen und Pilzen tragen ebenfalls den Namen Trypsin.
Mangel an Trypsin-1 führt beim Menschen zur Unterernährung durch Proteinmangel. Ursache kann eine Mutation am TRY1-Gen sein. Eine andere Folge einer solchen Mutation ist erbliche Pankreatitis, bei der körpereigenes Trypsin-1 nicht abgebaut werden kann und die Bauchspeicheldrüse verdaut. Mutation am Gen für Trypsin-2 kann zur chronischen Pankreatitis beitragen.[1]
Inhaltsverzeichnis
Biosynthese
Die Proteasen Trypsin, Chymotrypsin und Carboxypeptidasen werden als inaktive Zymogen-Vorstufen vom Pankreas abgesondert. Das Darmenzym Enteropeptidase, das an das Darmepithel gebunden ist, steuert die Umwandlung der Vorstufe Trypsinogen zu Trypsin. Trypsin aktiviert sich selbst (positive Rückkopplung) und wandelt Chymotrypsinogen, Proelastase wie auch Procarboxypeptidase und weitere inaktive Enzyme in deren aktive Formen (Chymotrypsin, Elastase und Carboxypeptidase) um.
Biologische Funktion
Trypsin gehört zu den Endopeptidasen, die Proteine an bestimmten Stellen spalten. Trypsin ist eine Serinprotease. Trypsin spaltet selektiv nach Darmregion Peptidbindungen nach den Aminosäuren Lysin, Arginin und auch nach modifiziertem Cystein. Proteinasen sind nicht auf bestimmte Proteine spezialisiert, sondern auf bestimmte Aminosäurensequenzen Strukturmerkmale innerhalb der Proteine; dies ist für den Verdauungsvorgang wichtig, da ansonsten im Dünndarm für jedes vorkommenden Eiweiß ein spezifisches Enzym benötigen würde.
Endopeptidasen sind wichtige Substanzen bei der chemisch-analytischen Sequenzierung von Proteinen. Die gespaltenen (denaturierten) Eiweiße werden leicht hydrolysiert und binden Wassermoleküle an sich.
Eine ähnliche Funktion und Wirkung hat das von der Magenwand freigesetzte Pepsin.
Verwendung
Trypsin besitzt ein pH-Wert-Optimum von 7-8, arbeitet also bei basischen Bedingungen (wie sie im Dünndarm auch tatsächlich vorliegen) am effektivsten.
In Zellkulturlabors wird Trypsin verwendet, um adhärente Zellen vom Boden der Kulturschalen zu lösen bzw. um Zellen zu vereinzeln. Solange man die Zellen nicht zu lange mit Trypsin behandelt, werden sie nicht geschädigt und nur die extrazellulären Proteine werden gespalten.
In der Proteomik ist Trypsin die am häufigsten eingesetzte Protease, um für die massenspektrometrische Analyse Peptide zu erzeugen, z.B. beim In-Gel-Verdau.
Für die Chromosomenanalyse in Form eines Karyogramms werden in der GTG-Bänderungstechnik die Chromosomen mit Trypsin behandelt und anschließend nach Giemsa gefärbt.[2]
Nachweisreaktion
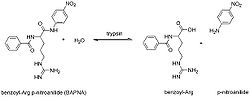
Die Aktivität von Trypsin kann durch N-Benzoyl-D,L-Arginin-p-nitroanilin (BAPNA) nachgewiesen werden. Dabei wird BAPNA durch das Trypsin am Arginin gespalten und es entsteht p-Nitroanilin. Die Konzentration von p-Nitroanilin kann bei einer Wellenlänge von 405 nm spektroskopisch nachgewiesen werden.
Einzelnachweise
- ↑ OMIM: Trypsin-1
- ↑ GTG-Bänderung (G-bands by trypsin using Giemsa). Institut für Humangenetik im Universitätsklinikum Jena, abgerufen am 14. März 2011.
Weblinks
- Jennifer McDowall/Interpro: Protein Of The Month: Trypsin and Chymotrypsin. (engl.)
Kategorien:- ATC-B06
- ATC-D03
- Peptidase
- Bauchspeicheldrüse
- Proteingruppe
- ATC-M09
Wikimedia Foundation.