- Disauerstoffdifluorid
-
Strukturformel 
Allgemeines Name Disauerstoffdifluorid Andere Namen Fluorperoxid
Summenformel F2O2 CAS-Nummer 7783-44-0 PubChem 123257 Kurzbeschreibung braunes Gas
Eigenschaften Molare Masse 70,0 g·mol−1 Aggregatzustand gasförmig
Dichte Schmelzpunkt Siedepunkt −57 °C[1]
Sicherheitshinweise EU-Gefahrstoffkennzeichnung [2] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Disauerstoffdifluorid ist eine chemische Verbindung aus der Gruppe der Fluoride, genauer der Sauerstofffluoride.
Inhaltsverzeichnis
Gewinnung und Darstellung
Disauerstoffdifluorid kann durch Reaktion von Sauerstoff und Fluor mithilfe einer elektrischen Entladung gewonnen werden.[1] Die erste Synthese geht auf Otto Ruff aus dem Jahr 1933 zurück.[3]
Eigenschaften
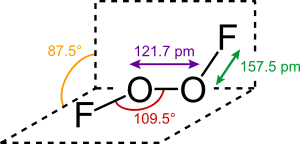
Disauerstoffdifluorid ist als Gas braun, als Flüssigkeit kirschrot und im festen Zustand orangegelb.[1] Die Struktur des Feststoffs entspricht der von Wasserstoffperoxid.[4]
Es ist instabil (Zersetzung ab −95 °C)[5] und ein starkes Oxidations- und Fluoridierungsmittel. So oxidiert es Chlor zu Chlorfluorid und Chlortrifluorid, sowie Schwefelwasserstoff zu Schwefelhexafluorid.[6]
Einzelnachweise
- ↑ a b c d e f Brauer; Handbuch der präparativen anorganischen Chemie
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Otto Ruff, W. Menzel: Neue Sauerstofffluoride: O2F2 und OF. In: Zeitschrift für anorganische und allgemeine Chemie. 211, Nr. 1–2, 1933, S. 204–208. doi:10.1002/zaac.19332110122.
- ↑ A. J. Bridgeman, J. Rothery: "Bonding in mixed halogen and hydrogen peroxides", Journal of the Chemical Society, Dalton Transactions, 1999, S. 4077–4082; doi:10.1039/a904968a.
- ↑ Holleman und Wiberg: Lehrbuch der anorganischen Chemie; ISBN 978-3-11-012641-9.
- ↑ Ralf Steudel: Chemie der Nichtmetalle; ISBN 978-3-11-012322-7.
Weblinks
Kategorien:- Sauerstoffverbindung
- Fluorverbindung
Wikimedia Foundation.