- Isoleucin
-
Strukturformel 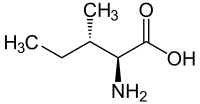
L-Isoleucin
Strukturen weiterer Isomere siehe StereochemieAllgemeines Name Isoleucin Andere Namen - α-Amino-β-methylvaleriansäure
- (2S,3S)-2-Amino-3-methylpentan-säure
- Abkürzungen:
- Ile (Dreibuchstabencode)
- I (Einbuchstabencode)
Summenformel C6H13NO2 CAS-Nummer - 73-32-5 L-Isoleucin
- 319-78-8 D-Isoleucin
- 1509-34-8 L-allo-Isoleucin
- 1509-35-9 D-allo-Isoleucin
PubChem 791 ATC-Code V06[1]
DrugBank NUTR00031 Kurzbeschreibung farbloser Feststoff mit schwachem Geruch [1]
Eigenschaften Molare Masse 131,17 g·mol−1 Aggregatzustand fest
Schmelzpunkt Zersetzung: 284 °C (L-Isoleucin)[1]
pKs-Wert Löslichkeit löslich in Wasser: 40 g·l−1 (20 °C, L-Isoleucin)[1]
Sicherheitshinweise Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln EU-Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. L-Isoleucin, abgekürzt Ile oder I, ist eine essentielle proteinogene α-Aminosäure, die zur Aspartatgruppe zählt, sich also von der Asparaginsäure ableitet.
Isoleucin besitzt zwei Stereozentren, somit existieren vier Stereoisomere, in unserer Umwelt spielt jedoch nur das L-Isoleucin als proteinogene Aminosäure eine Rolle und ist physiologisch bedeutsam.
L-Leucin, L-Norleucin und L-tert-Leucin sind Konstitutionsisomere des L-Isoleucins und des L-allo-Isoleucins. Das gilt auch für deren Isomere mit D-Konfiguration.
Inhaltsverzeichnis
Geschichte
L-Isoleucin wurde erstmals 1904 von Felix Ehrlich aus entzuckerter Melasse isoliert.
Vorkommen
Isoleucin ist Bestandteil tierischen und pflanzlichen Proteins. Die folgenden Beispiele beziehen sich jeweils auf 100 g des Lebensmittels, zusätzlich ist der prozentuale Anteil von Isoleucin am Gesamtprotein angegeben.[3]
-
Lebensmittel Gesamtprotein Isoleucin Anteil Rindfleisch, roh 21,26 g 967 mg 4,5 % Hähnchenbrustfilet, roh 23,09 g 1219 mg 5,3 % Lachs, roh 20,42 g 968 mg 4,7 % Hühnerei 12,58 g 672 mg 5,3 % Kuhmilch, 3,7 % Fett 3,28 g 198 mg 6,0 % Walnüsse 15,23 g 625 mg 4,1 % Weizen-Vollkornmehl 13,70 g 508 mg 3,7 % Mais-Vollkornmehl 6,93 g 248 mg 3,6 % Reis, ungeschält 7,94 g 336 mg 4,2 % Erbsen, getrocknet 24,55 g 1014 mg 4,1 %
Eigenschaften
Isoleucin liegt am isoelektrischen Punkt (einem bestimmten pH-Wert) als Zwitterion (inneres Salz) vor, d. h. das Proton der Carboxygruppe (–COOH) ist abdissoziiert und protoniert die Aminogruppe (–NH2).
- Seitenkette: lipophil
- isoelektrischer Punkt: 5,94[4]
- van-der-Waals-Volumen: 124
- Lipidlöslichkeit: LogP = 4,5
Stereochemie
Isoleucin besitzt zwei Stereozentren, somit existieren vier Stereoisomere, physiologisch bedeutsam ist jedoch nur das L-Isoleucin als proteinogene Aminosäure. Enantiomer zum natürlichen L-Isoleucin ist das D-Isoleucin. L-allo-Isoleucin und dessen Enantiomer D-allo-Isoleucin sind Diastereomere von L-Isoleucin.
Isomere von Isoleucin Name L-Isoleucin D-Isoleucin L-allo-Isoleucin D-allo-Isoleucin Strukturformel 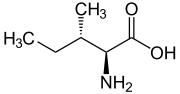
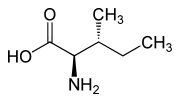
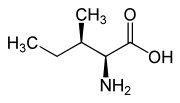
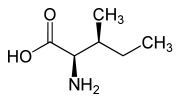
Andere Namen - (2S,3S)-2-Amino-3-methylpentansäure
- (S)-Isoleucin
- (2R,3R)-2-Amino-3-methylpentansäure
- (2R,3R)-2-Amino-3-methylvaleriansäure
- (R)-Isoleucin
- (2S,3R)-2-Amino-3-methylpentansäure
- (2R,3S)-2-Amino-3-methylpentansäure
CAS-Nummer 73-32-5 319-78-8 1509-34-8 1509-35-9 PubChem 6306 76551 99288 94206 Schmelzpunkt Zersetzung: 284 °C[1] Biochemische Bedeutung
Einerseits wird Isoleucin als Baustein für den Proteinaufbau benötigt. Andererseits kann es auch zur Energiegewinnung in Muskelzellen dienen. Das spielt bei proteinreicher Kost eine Rolle oder aber bei längeren Anstrengungen und in Hungerphasen, wenn der Körper auf eigene Reserven zurückgreift. Der Abbau von Isoleucin liefert Acetyl-CoA und Propionyl-CoA.[5]
Die Einschätzungen des Tagesbedarfs für gesunde Erwachsene reichen, je nach verwendeter Methode, von 7,5 bis 28 mg Isoleucin pro Kilogramm Körpergewicht.[6] Im menschlichen Organismus kommt Isoleucin fast nur in gebundenem Zustand vor. Die Konzentration von freiem Isoleucin im Blut beträgt rund 7 mg/l, über den Urin werden pro Tag 10 bis 15 mg ausgeschieden.[7]
Gewinnung
L-Isoleucin wird vorwiegend durch Fermentation von Glukoselösungen hergestellt, die L-Threonin enthalten.[8][9] Durch Hydrolyse von Proteinhydrolysaten und nachfolgende Trennoperationen erhält man ein Gemisch der natürlichen Aminosäuren L-Leucin und L-Isoleucin. Diese Konstitutionsisomeren lassen sich z. B. nach einem enzymatischen Verfahren trennen.[10]
Verwendung
Als Bestandteil von Aminosäure-Infusionslösungen [Aminoplasmal® (D), Aminosteril®-N-Hepa (D), Primene® (A)] zur parenteralen Ernährung findet L-Isoleucin, neben anderen Aminosäuren, breite Anwendung in der Humanmedizin. Für Patienten mit gestörter Verdauung wurde eine oral anzuwendende „chemisch definierte Diät“ entwickelt, die L-Isoleucin enthält. In dieser Diät bilden die Aminosäuren die Stickstoffquelle; alle lebensnotwendigen Nährstoffe liegen in chemisch genau definierter Form vor.[8]
Einzelnachweise
- ↑ a b c d e Eintrag zu L-Isoleucin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 19. Januar 2008 (JavaScript erforderlich).
- ↑ a b Hans Beyer und Wolfgang Walter: Lehrbuch der Organischen Chemie, Hirzel Verlag, Stuttgart, 1991, ISBN 3-7776-0485-2, S. 823.
- ↑ Nährstoffdatenbank des US-Landwirtschaftsministeriums, 21. Auflage.
- ↑ Bernd Hoppe und Jürgen Martens: Aminosäuren – Herstellung und Gewinnung, in: Chemie in unserer Zeit, 1984, 18, S. 73–86.
- ↑ J. M. Berg, J. L. Tymoczko, L. Stryer: Biochemie. 6. Auflage. Spektrum Akademischer Verlag, Elsevier GmbH, München 2007; S. 735, 746; ISBN 978-3-8274-1800-5.
- ↑ A. V. Kurpad, M. M. Regan, T. Raj, J. V. Gnanou: Branched-chain amino acid requirements in healthy adult human subjects, in: J. Nutr., 2006, 136 (1 Suppl), S. 256S–263S; PMID 16365094.
- ↑ Roche Lexikon Medizin. 5. Auflage. Urban & Fischer Verlag, Elsevier GmbH, München 2003; ISBN 978-3-437-15150-7.
- ↑ a b Yoshiharu Izumi, Ichiro Chibata und Tamio Itoh: Herstellung und Verwendung von Aminosäuren, in: Angewandte Chemie, 1987, 90, S. 187–194; Angewandte Chemie International Edition in English, 1978, 17, S. 176–183.
- ↑ Hitoshi Enei, Kenzo Yokozeki und Kunihiko Akashi: Recent Progress in Microbial Production of Amino Acids, Gordon & Breach Science Publishers 1989, ISBN 978-2-88124-324-0, S. 1–160.
- ↑ Jürgen Martens und Horst Weigel: Enzymatic Separation of L-Leucine and L-Isoleucine, in: Liebigs Annalen der Chemie, 1983, S. 2052–2054.
Weblinks
 Wikibooks: Biochemie und Pathobiochemie: Valin-, Leucin- und Isoleucin-Stoffwechsel – Lern- und Lehrmaterialien
Wikibooks: Biochemie und Pathobiochemie: Valin-, Leucin- und Isoleucin-Stoffwechsel – Lern- und Lehrmaterialien Proteinogene Aminosäuren
Proteinogene AminosäurenAlanin | Arginin | Asparagin | Asparaginsäure | Cystein | Glutamin | Glutaminsäure | Glycin | Histidin | Hydroxylysin | Isoleucin | Leucin | Lysin | Methionin | Phenylalanin | Prolin | Pyrrolysin | Selenocystein | Selenomethionin | Serin | Threonin | Tryptophan | Tyrosin | Valin
Wikimedia Foundation.
Schlagen Sie auch in anderen Wörterbüchern nach:
Isoleucin — Isoleucin, Abk. Ile, Proteinbaustein; für den Menschen essentielle Aminosäure mit reiner Kohlenwasserstoffseitenkette; kommt reichlich in Hämoglobin, den Serumproteinen und Casein vor … Deutsch wörterbuch der biologie
Isoleucin — I|so|leu|cin [↑ iso (2) u. ↑ Leucin] Symbol: I, Ile; Syn.: 2 Amino 3 methylpentansäure: H5C2 CH(CH3) CH(NH2) COOH; farblose, optisch aktive Krist., Smp. 284 °C ((+) L I.). Die aus Casein, Hefen, Melasse u. versch. Pflanzen isolierbare Aminosäure… … Universal-Lexikon
Isoleucin — Iso|leu|cin [... tsi:n] vgl. ↑Isoleuzin … Das große Fremdwörterbuch
Sek-Butylglycin — In diesem Artikel oder Abschnitt fehlen folgende wichtige Informationen: Eigenschaften, biochemische Bedeutung, Biosynthese ... Du kannst Wikipedia helfen, indem du sie recherchierst und einfügst … Deutsch Wikipedia
Aminosäuren — (unüblich Aminocarbonsäuren, veraltet Amidosäuren), sind eine Klasse organischer Verbindungen mit mindestens einer Carboxygruppe (–COOH) und einer Aminogruppe (–NH2). Die Stellung der Aminogruppe zur Carboxygruppe teilt die Klasse der Aminosäuren … Deutsch Wikipedia
Amidosäure — Aminosäuren (unüblich Aminocarbonsäuren, veraltet Amidosäuren), sind eine Klasse organischer Verbindungen mit mindestens einer Carboxylgruppe (–COOH) und einer Aminogruppe (–NH2). Die Stellung der Aminogruppe zur Carboxylgruppe teilt die Klasse… … Deutsch Wikipedia
Aminocarbonsäure — Aminosäuren (unüblich Aminocarbonsäuren, veraltet Amidosäuren), sind eine Klasse organischer Verbindungen mit mindestens einer Carboxylgruppe (–COOH) und einer Aminogruppe (–NH2). Die Stellung der Aminogruppe zur Carboxylgruppe teilt die Klasse… … Deutsch Wikipedia
Aminocarbonsäuren — Aminosäuren (unüblich Aminocarbonsäuren, veraltet Amidosäuren), sind eine Klasse organischer Verbindungen mit mindestens einer Carboxylgruppe (–COOH) und einer Aminogruppe (–NH2). Die Stellung der Aminogruppe zur Carboxylgruppe teilt die Klasse… … Deutsch Wikipedia
Aminosäure — Aminosäuren (unüblich Aminocarbonsäuren, veraltet Amidosäuren), sind eine Klasse organischer Verbindungen mit mindestens einer Carboxylgruppe (–COOH) und einer Aminogruppe (–NH2). Die Stellung der Aminogruppe zur Carboxylgruppe teilt die Klasse… … Deutsch Wikipedia
Aminosäurenstoffwechsel — Aminosäuren (unüblich Aminocarbonsäuren, veraltet Amidosäuren), sind eine Klasse organischer Verbindungen mit mindestens einer Carboxylgruppe (–COOH) und einer Aminogruppe (–NH2). Die Stellung der Aminogruppe zur Carboxylgruppe teilt die Klasse… … Deutsch Wikipedia
