- Kollagen
-
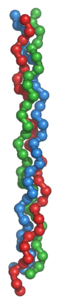
Kollagen Kollagen-Tripelhelix Masse/Länge Primärstruktur 3 x 200-1000 Aminosäuren Sekundär- bis Quartärstruktur Tripelhelix Präkursor Prokollagen-Polypeptidketten und Prokollagen Isoformen 29 beim Menschen Vorkommen Übergeordnetes Taxon Gewebetiere Ausnahmen bei Hohltieren nicht nachgewiesen Kollagen (früher: Tropokollagen; internationalisierte Schreibweise Collagen; Betonung auf der letzten Silbe) ist ein nur bei Vielzelligen Tieren (auch bei Menschen), vorkommendes Strukturprotein hauptsächlich des Bindegewebes (genauer: der extrazellulären Matrix). Im menschlichen Körper ist Kollagen mit über 30 % Anteil am Gesamtgewicht aller Eiweiße (Proteine) das am meisten verbreitete Eiweiß. Es ist ein wesentlicher organischer Bestandteil des Bindegewebes (Knochen, Zähne, Knorpel, Sehnen, Bänder) und der Haut. Kollagenfasern besitzen eine enorme Zugfestigkeit und sind kaum dehnbar. Seinen Namen erhielt das Kollagen (aus dem Griechischen: Leim erzeugend) ursprünglich aufgrund seiner früheren Nutzung als Knochenleim im Holzhandwerk. Es ist der Hauptgrundstoff für die Herstellung von Gelatine.
Die Polypeptidketten des Kollagens werden durch die Ribosomen des rauen endoplasmatischen Retikulums synthetisiert. Kollagen besteht aus α-helikalen Peptidketten, die untypischerweise eine linksgängige Helix aufweisen. Drei dieser Helices, welche untereinander Wasserstoffbrücken ausbilden können, umschlingen einander zu einer rechtsgängigen Superhelix. Auffallend an der Primärstruktur (Aminosäuresequenz) des Kollagens ist, dass jede dritte Aminosäure Glycin ist. Ein häufig wiederholtes Sequenzmotiv ist Prolin-Hydroxyprolin-Glycin (siehe Multigen-Familie). Die dichte Wicklung ist ausschlaggebend für die hohe Zugfestigkeit von Kollagenfasern: die Fasern können Gewichte bis zum Zehntausendfachen ihres Eigengewichtes tragen.
Im allgemeinen Sprachgebrauch wird Kollagen Typ I gleichgesetzt mit „Kollagen“. Kollagen Typ I ist zwar mengenmäßig im Organismus das bedeutendste Kollagen und durch seine Verwendung als Gelatine das bekannteste, es existieren jedoch weitere Kollagene, die sich strukturell wesentlich vom Kollagen Typ I unterscheiden und andere wichtige biologische Funktionen wahrnehmen. Gelatine ist die denaturierte Form von fibrillärem Kollagen Typ I, II und/oder III und wird meist aus Schlachtabfällen gewonnen. Hierbei ist zu beachten, dass Kollagen Typ II vornehmlich im Knorpel vorkommt, Gemische von Kollagen Typ I und III stammen aus Sehnen, Bändern und der Haut.
Inhaltsverzeichnis
Aufbau
Kollagenmolekül
Als Kollagenmolekül oder Tropokollagen werden nur tripelhelikale Moleküle der extrazellulären Matrix (EZM) bezeichnet. Sie haben gemeinsam, dass sie aus drei Polypeptidketten aufgebaut sind. Diese liegen jeweils in linksgängigen Kollagen-Helices (α-Ketten) vor und sind gemeinsam in Form der charakteristischen rechtshändigen Tripelhelix umeinander gewunden (s. Bild rechts). Jede einzelne Kollagen-Helix kann in Abhängigkeit vom Kollagentyp aus 600 bis 3000 Aminosäuren zusammengesetzt sein und ist mit großen Domänen ausgestattet, die aus sich wiederholenden (repetitiven) G-X-Y-Sequenzen aufgebaut sind:
Somit befindet sich an jeder dritten Position ein Glycin (G)-Rest. Glycin als die kleinste Aminosäure passt ideal in die Tripelhelix mit seinen sehr engen Windungen. Die Aminosäure Prolin ist sehr häufig an Position X zu finden. Prolin fungiert hier aufgrund seiner starren Ringstruktur als „Ecke“ in der Polypeptidkette und unterstützt die Ausbildung von engen Windungen innerhalb der Tripelhelix. 4-Hydroxyprolin ist überwiegend an Position Y lokalisiert und stabilisiert die Tripelhelix über Wasserstoffbrücken zwischen benachbarten Polypeptidketten. Durch die Verwendung von Glycin, Prolin und Hydroxyprolin wird die Rotation der Polypeptidkette begrenzt und den engen Raumbedingungen innerhalb der Tripelhelix Rechnung getragen.
Strukturebene molekularer Bereich Primärstruktur (= Sequenz) Polypeptidketten mit repetitiven G-X-Y-Sequenzen Sekundärstruktur α-Helix Tertiärstruktur linksgängige Kollagen-Helices (α-Ketten) Quartärstruktur rechtshändige Tripelhelix aus 3 Polypeptidketten Überstruktur Kollagenfibrille(n) und Kollagenfaser Das Vorkommen von Hydroxylysin neben Hydroxyprolin ist ebenfalls charakteristisch für Kollagen. Hydroxylysin bildet die Voraussetzung für die Ausbildung kovalenter Quervernetzungen, womit die einzelnen Tripelhelices innerhalb der Kollagenfibrillen räumlich fixiert werden können.
Kollagenfibrille
In den Fibrillen sind benachbarte Kollagenmoleküle nicht bündig angeordnet, sondern um 67 nm, d.h. um etwa ein Fünftel ihrer Länge, gegeneinander versetzt. Diese Anordnung hat zur Folge, dass auf elektronenmikroskopischen Aufnahmen von Metall-kontrastierten Kollagenfibrillen eine Querstreifung zu sehen ist. Es entsteht ein charakteristisches Bänderungsmuster, das sich alle 67 nm (234 Aminosäuren) wiederholt und als D-Periode bezeichnet wird. Dadurch werden die α-Ketten in vier homologe Bereiche D1–D4 unterteilt. Die in einer D-Einheit auftretenden Banden werden mit a-e bezeichnet. Die Kollagen-Fibrillen sind geordnete Polymere, die im ausgereiften Gewebe viele Mikrometer lang werden können. Sie sind oft zu größeren, kabelartigen Bündeln, den Kollagenfasern, zusammengefasst. Bei Sehnen betragen die Kollagen Typ I Fibrillendurchmesser 50–500 nm, in der Haut 40–100 nm und in der Kornea (Hornhaut des Auges) 25 nm. Die Fibrillogenese des Kollagens wird oftmals durch kleine leucinreiche Proteoglykane reguliert, so dass in den entsprechenden Geweben Fibrillen mit definiertem Durchmesser und definierter Anordnung entstehen können.
Strukturaufklärung
Das heutige Bild der Kollagen-Tripelhelix und die räumliche "Einordnung" der Aminosäurereste und ihrer Wasserstoffbrücken untereinander geht maßgeblich auf die Röntgen-kristallographischen Arbeiten der indischen Wissenschaftler G. N. Ramachandran und Gopinath Kartha zurück (1954).
Wesentliche Aufklärung (die gesamte Primärstruktur des Typ I Kollagens sowie die Makrostrukturen der Typen IV und VI) leistete das ehemalige Max-Planck-Institut für Eiweiß- und Lederforschung in München (1956 zur Aufklärung des Bindegewebes durch Sponsoring der Lederindustrie gegründet) ab 1966 unter der Leitung von Professor Klaus Kühn (nach Institutsverlegung am Max-Planck-Institut für Biochemie in Martinsried).[1]
Biosynthese
Kollagen Typ I wird unter anderem von spezialisierten Zellen (Fibroblasten, Myofibroblasten und Osteoblasten) synthetisiert.
Die einzelnen Kollagen-Polypeptidketten werden am rauen endoplasmatischen Retikulum hergestellt (Translation) und in das Lumen des endoplasmatischen Retikulums transportiert. Dabei liegen sie in Form größerer Vorläufermoleküle, den Pro-α-Ketten, vor, die mit N- und C-terminalen Propeptiden versehen sind. Im endoplasmatischen Reticulum werden an einzelne Prolin- und Lysin-Reste entstehender oder bereits entstandener Polypeptidketten OH-Gruppen angehängt (Hydroxylierung). Durch Ausbildung von Disulfidbindungen zwischen den C-terminalen Propeptiden wird die Tripelhelixbildung eingeleitet. Drei Pro-α-Ketten formieren dabei über Wasserstoffbrücken ein dreisträngiges Helixmolekül, das Prokollagen. Schließlich erfolgt meist eine Glycosylierung mancher Lysinreste. Die fibrillären Kollagene werden in dieser Form aus der Zelle entlassen. Die Abgabe der Moleküle in den extracellulären Raum erfolgt durch Exozytose mittels sekretorischer Vesikel, woran die Glycosylbestandteile beteiligt zu sein scheinen. Unmittelbar nach der Abgabe aus der Zelle werden die Propeptide mit Hilfe von Prokollagen-Peptidasen abgespalten. Das Kollagenmolekül nennt man in dieser Phase Tropokollagen. Anschließend lagern sich einzelne Tropokollagen-Moleküle zu Kollagen-Fibrillen zusammen (Fibrillogenese).
Hydroxylierungen
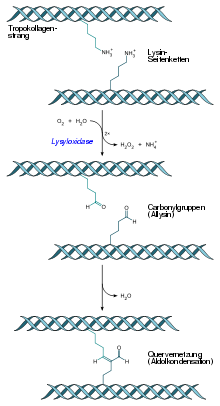 Quervernetzung eines Tropokollagenstrangs durch Aldolkondensation von Allysin-Resten nach der Oxidation von Lysin-Resten
Quervernetzung eines Tropokollagenstrangs durch Aldolkondensation von Allysin-Resten nach der Oxidation von Lysin-Resten
Ascorbinsäure (Vitamin C) ist ein wichtiger Co-Faktor bei der Hydroxylierung der Aminosäuren Prolin zu Hydroxyprolin durch das Enzym Prolylhydroxylase und Lysin zu Hydroxylysin durch das Enzym Lysylhydroxylase. Hydroxyprolin kommt die Funktion zu, über Wasserstoffbrücken zwischen benachbarten Kollagen-Polypeptidketten die Tripelhelix innerhalb eines Kollagenmoleküls zu festigen. Hydroxylysin dient der Verankerung von kovalenten Quervernetzungen zwischen Kollagenmolekülen. Bei fehlender Hydroxylierung werden nur schadhafte Kollagenmoleküle gebildet, die ihrer Funktion als Strukturprotein nicht nachkommen können. Hierbei ist anzumerken, dass nahezu alle Symptome der Ascorbinsäure-Mangelerkrankung Skorbut auf die fehlerhafte Biosynthese des Kollagens zurückzuführen sind.
Fibrillenbildung
In weiteren Schritten kommt es zur Ausbildung von Kollagenfibrillen. Nachdem sich einzelne tripelhelikale Kollagenmoleküle um ein Fünftel ihrer Länge versetzt aneinander gelagert haben, erfolgen kovalente Quervernetzungen über dann nahestehende Hydroxylysinreste, womit die räumliche Anordnung dauerhaft fixiert wird. Viele derartiger Kollagenfibrillen bilden schließlich Kollagenfasern.
Kollagentypen
Die Kollagene werden in mehrere Untergruppen unterteilt.
Kollagen Typ I, ein fibrilläres Kollagen, kommt in vielen Bindegeweben der Säugetiere vor, am häufigsten in Haut und Knochen, auch in Sehnen, aber nicht im hyalinen und elastischen Knorpel vor, während Kollagen Typ II in der Hornhaut des Auges und in Faserknorpel vorkommt. Kollagen Typ IV findet man mit Laminin zu Netzwerken verknüpft.
Zurzeit sind 29 verschiedene Kollagentypen bekannt (Typ I bis XXIX) sowie mindestens zehn weitere Proteine mit kollagenähnlichen Domänen.
In der folgenden Zusammenstellung sind einige Mitglieder der Kollagenfamilie aufgeführt.
Art Typ Fibrilläre Kollagene Kollagene des Typs I, II, III, V und XI Netzbildende Kollagene Kollagene des Typs IV (Lamina densa der Basalmembran), VIII und X Fibrillenassoziierte Kollagene (FACIT) Kollagene des Typs IX, XII, XIV, XXII Perlenschnurartige Kollagene Kollagen Typ VI Verankerungsfibrillen Kollagen Typ VII Kollagene mit Transmembrandomänen Kollagene des Typs XIII, XVII, XXIII und XXV Ein Spaltprodukt des Collagen XVIII ist das Endostatin mit einer Molekülmasse von 20 kDa.
Aufbau des Kollagens Typ I
Die drei Kollagen-Polypeptidketten sind im Falle von Kollagen Typ I die α-Ketten, [α1(I)2α2(I)], die sich zu einer Tripelhelix umeinander winden. Das Gen der α1-Kette von Kollagen Typ I besteht aus 50 Exons, von denen über die Hälfte eine Länge von 54 Basenpaaren (bp) oder das zwei- bis dreifache dieser Länge besitzen. Sie codieren für die Sequenz (G-X-Y)6 oder ein Vielfaches davon.
Nutzung
Kollagen wird vor allem in Form der Gelatine genutzt, die aus Rinderspalt, Schweineschwarten sowie Knochen von Rindern und Schweinen gewonnen wird.
Ernährung und Futterstoffe
In Deutschland werden jährlich etwa 32.000 t Gelatine in Speisequalität hergestellt, die europäische Gesamtproduktion beträgt 120.000 t (70 % Schweineschwarten, 18 % Knochen, 10 % Rinderspalt, 2 % Sonstige)[2] Verwendet werden in Deutschland etwa 90.000 t, wobei 2/3 auf den Ernährungsbereich und von dem Rest etwa die Hälfte auf den Futtermittelbereich entfallen.[3]
Pharma
Etwa 15.000 t werden in der chemischen und pharmazeutischen Industrie verarbeitet. Dabei stellen Umhüllungen von Tabletten und Vitaminpräparaten (Hart- und Weichkapseln) sowie Gelatinezäpfchen die Haupteinsatzbereiche in der Pharmaindustrie dar. Außerdem wird Gelatine für blutstillende Schwämmchen sowie als Blutplasma-Ersatz eingesetzt.
Kosmetik
Kollagen findet als Wirkstoff seit vielen Jahren auch in der Kosmetik Anwendung und soll dort hauptsächlich zur Minderung von Hautalterung, dem Anti-Aging, dienen. Heute finden Kollagenprodukte in der Kosmetik in Form von Cremes Verwendung. Das hierfür genutzte Kollagen wird meist aus Schweinehaut extrahiert.
Technik
In der analogen Fotografie stellt Gelatine die Basis für die fotoempfindlichen Schichten auf dem Film und dem Fotopapier. Auch moderne Druckerpapiere zum Ausdrucken von Farbbildern sind mit Gelatine beschichtet.[3]
Siehe auch
 Eine Plastik von Julian Voss-Andreae in San Francisco (Kalifornien, USA). Die Struktur der 3.40 m hohen Edelstahlskulptur ("Sich entwirrendes Kollagen") beruht auf kristallographischen Daten des Kollagenmoleküls.[4][5]
Eine Plastik von Julian Voss-Andreae in San Francisco (Kalifornien, USA). Die Struktur der 3.40 m hohen Edelstahlskulptur ("Sich entwirrendes Kollagen") beruht auf kristallographischen Daten des Kollagenmoleküls.[4][5]
Weblinks
Belege
- ↑ Kühn, K. (1974), Struktur und Biochemie des Kollagens. Chemie in unserer Zeit, 8: 97–103. doi: 10.1002/ciuz.19740080402.
- ↑ K. Rappold: Gelatine - Ein natürliches Nahrungsmittel. bmi aktuell 1/2004, Hrsg. Informationszentrale für Backmittel und Backgrundstoffe zur Herstellung von Brot und Feinen Backwaren e.V.
- ↑ a b Angaben auf der Website der Gelatine Manufacturers of Europe http://www.gelatine.de.
- ↑ : PDB Community Focus: Julian Voss-Andreae, Protein Sculptor. In: Protein Data Bank Newsletter. Nr. 32, Winter 2007.
- ↑ Barbara Ward: 'Unraveling Collagen' structure to be installed in Orange Memorial Park Sculpture Garden. In: Expert Rev. Proteomics. 3 (2), Nr. 2, April 2006. doi:10.1586/14789450.3.2.169.
Literatur
- S. Ayad, R.P. Boot-Hanford, M.J. Humphries, K.E. Kadler, C.A. Shuttleworth: The Extracellular Matrix (Facts Book). Academic Press (Harcourt Brace & Company, Publishers), Printed in Great Britain, S. 43 ff (1998), ISBN 0-12-068911-1
Kategorien:- Strukturprotein
- Proteingruppe
- ATC-B02
- ATC-D11
- ATC-G04
- Arzneistoff
- Histologie der Binde- und Stützgewebe
Wikimedia Foundation.