- Komplexchemie
-
Die Komplexchemie (Koordinationschemie) ist der Bereich der Anorganischen Chemie, der sich mit chemischen Komplexverbindungen befasst. Ein Komplex oder eine Koordinationsverbindung ist eine chemische Verbindung, bei der ein Zentralatom (Metall-Ion oder Atom) Lücken in seiner Elektronenkonfiguration aufweist, so dass sich ein oder mehrere Moleküle oder Ionen, die Liganden, anlagern können, die jeweils mindestens ein freies Elektronenpaar für die Bindung zur Verfügung stellen.
Die dadurch zwischen Ligand und Metall entstehende Bindung kann als polare kovalente Bindung betrachtet werden. Häufig wird dieser Bindungstyp als Komplexbindung, oder Koordinative Bindung bezeichnet, und von den anderen Formen der chemischen Bindung (kovalente Bindung, Ionenbindung, Metallbindung) unterschieden. Das ist insofern zu rechtfertigen, da das bindende Elektronenpaar ursprünglich vom Liganden stammt und nicht (wie in einer unpolaren kovalenten Bindung) je ein Elektron von jedem Bindungspartner.
Der Vorgang des Ligandenaustauschs bei Metallkomplexen in wässriger Lösung wird als Eigen-Wilkins-Mechanismus bezeichnet. Betrachtet man aber beispielsweise eine polare kovalente Bindung wie im H-Cl (Chlorwasserstoff), ist auch hier (wie in den Komplexen) die Betrachtung zutreffender, dass das bindende Elektronenpaar im Wesentlichen vom elektronegativeren Bindungspartner geliefert wird (hier Chlor), vergleichbar einem Liganden. Auch bezüglich der Stabilität von Metall-Ligand-Bindungen in Metallkomplexen stehen diese in Nichts den kovalenten Bindungen in Molekülen nach. Eine Unterscheidung zwischen koordinativer Bindung und polarer kovalenter Bindung ist also ein reiner Formalismus.
Die Liganden umschließen das Zentralatom – das Wort Komplex leitet sich vom lateinischen Verb complecti bzw. seinem Partizip complexus ab, dessen deutsche Entsprechung umarmen, umschließen ist.
Komplexverbindungen spielen in der Biologie oft eine entscheidende Rolle, so enthalten die für das Leben außerordentlich wichtigen Verbindungen Hämoglobin und Chlorophyll Metallkomplexe.
Viele Komplexverbindungen sind farbig und können daher als Farbstoffe eingesetzt werden. Häufig sind Komplexverbindungen aus entsprechenden Salzen eines Zentralions zugänglich. Beispielsweise färbt sich wasserfreies, weißes Kupfersulfat bei Zugabe von Wasser (Aqua) hellblau. Es entsteht ein Aqua-Komplex des Kupfers, bei dem sechs Wassermoleküle als Liganden des Zentralions auftreten (Komplexbildungsreaktion):
Der Pionier der Koordinationschemie, Alfred Werner, erhielt im Jahre 1913 den Nobelpreis für Chemie für seine richtige Deutung der Struktur- und Bindungsverhältnisse in Komplexen.
Prinzipien
Die Komplexbildungsreaktion ist eine klassische Säure-Base-Reaktion nach der Theorie von Gilbert Newton Lewis. Hierbei stellt das Zentralatom (meistens ein Metallkation, am häufigsten Übergangsmetalle) die Lewis-Säure (Elektronenpaar-Akzeptor) dar; die Lewis-Base ist der Ligand, ein Molekül oder ein Ion, welches mindestens ein freies Elektronenpaar (Elektronenpaar-Donator) zur Bindungsbildung zur Verfügung stellen kann. Diese Art der chemischen Bindung wird als koordinative Bindung bezeichnet. Da in Komplexen die Zahl der Bindungspartner (hier: Liganden) mit dem Zentralatom (= Bindigkeit) völlig unabhängig von der Oxidationsstufe des Zentralatoms ist (= Wertigkeit), spricht man auch von Verbindungen höherer Ordnung.
Die Zentralteilchen sind häufig Kationen, sie können aber auch neutral oder (selten) Anionen sein:
Die Liganden können anorganischer oder organischer Natur sein:
- anorganische Liganden:
- organische Liganden:
- Porphin-Ringsystem (z. B. Chlorophyll, Hämoglobin), einige Polycyclen (z.B. Alizarin, 8-Hydroxychinolin, Phenanthrolin), Tartrate, Ethylendiamin, Acetylaceton, EDTA („Titriplex“), NTA,
Die Nomenklatur von Komplexverbindungen
Regeln für die Nomenklatur: Zur systematischen Benennung von Komplexsalzen gibt man zuerst das Kation (gleichgültig ob komplex oder nicht) und dann das Anion an. Die Nennung der Bestandteile einer Koordinationseinheit geschieht in folgender Reihenfolge:
- Die Anzahl der Liganden wird durch vorangestellte griechische Zahlwörter angegeben: mono, di, tri, tetra, penta, hexa, hepta, octa usw. Bei Liganden mit komplizierten Namen oder zur Vermeidung von Mehrdeutigkeiten (z. B. dithiosulfat) verwendet man die aus dem griechischen abgeleiteten Multiplikatoren: bis, tris, tetrakis, pentakis, hexakis, heptakis, octakis usw. Der hierdurch vervielfachte Teil kommt in Klammern.
- Art der Liganden: Die verschiedenen Liganden werden ohne Berücksichtigung ihrer Anzahl und ihrer Ladung in alphabetischer Reihenfolge genannt. Anionische Liganden erhalten die Endung -o an ihren Anionennamen (z. B. Chlorido). Die Namen neutraler oder kationischer Liganden werden nicht verändert. Ausnahmen von dieser Regel sind die Namen von Wasser (aqua), Ammoniak (ammin), CO (carbonyl) und NO (nitrosyl).[1]
- Zentralion: In einem komplexen Anion erhält das Zentralion (mit lateinischem Wortstamm) die Endung -at. Ist der Komplex ein Kation oder ein neutrales Molekül, dann ändert sich der Name des Zentralions (mit deutscher Bezeichnung) nicht,
- Ladung des Zentralions: Die Ladung des Zentralions (= Oxidationszahl) wird durch eine in runden Klammern gesetzte römische Ziffer („Stock-Zahl“) angegeben und dem Namen der Koordinationseinheit nachgestellt. (Ein Pluszeichen wird nicht geschrieben; für Null wird die arabische Ziffer 0 benutzt.)
Der vollständige Name der Koordinationseinheit wird in einem Wort geschrieben. Bis auf die Namen der Liganden aqua, ammin und nitrosyl werden die Namen aller neutraler Liganden in Klammern gesetzt. Die Namen anorganischer anionischer Liganden werden dann in runde Klammern gesetzt, wenn sie bereits numerische Vorsilben enthalten oder wenn dadurch Mehrdeutigkeiten vermieden werden. Im Namen von Komplexsalzen wird zwischen den Namen des Kations und des Anions ein Bindestrich geschrieben.
Beispiel:
- K3[Fe(CN)6] Kalium-hexacyanidoferrat(III).
Chemische Formel
- Die Koordinationseinheit wird in eckigen Klammern dargestellt. Eine eventuell vorhandene Ladung wird als Exponent hinter der eckigen Klammer geschrieben, wobei diese sich aus der Summe der Ladungen aller Teilchen der Koordinationseinheit ergibt. In diesem Fall wird die Koordinationseinheit auch als Komplexion bezeichnet.[2]
- Das Zentralatom wird vor den Liganden genannt.
- Anionische Liganden werden vor Neutralliganden aufgeführt.
- Für mehratomige Liganden werden runde Klammern verwendet.
Namen von Komplexverbindungen
- Liganden kommen in alphabetischer Reihenfolge vor dem Namen des Zentralatoms. Mehrfach auftretende Liganden erhalten folgende (griechische) Vorsilben: di (2), tri (3), tetra (4), penta (5), hexa (6), hepta (7), okta (8), nona (9).
- Anionische Liganden erhalten die Endung „-o“.
- Wichtige anionische Liganden:'
-
- F− (fluorido); Cl− (chlorido); Br− (bromido); I− (iodido)
- Der Name ist der Ionenname + o. Die Bezeichnungen Fluoro, Chloro, etc. sind inzwischen veraltet und werden nur noch als Trivialnamen von sehr geläufigen Verbindungen verwendet.
- F− (fluorido); Cl− (chlorido); Br− (bromido); I− (iodido)
-
- O2− (oxido); O22− (peroxido); OH− (hydroxido); H− (hydrido)
-
- NO2− (nitrito, nitro bei Koordination über N bzw. nitrito-N und nitrito-O)
-
- CN− (cyanido, isocyanido bei Koordination über N bzw. cyanido-C und cyanido-N)
-
- SCN− (thiocyanato bzw. isothiocyanato bei Koordination über N)
- Wichtige neutrale Liganden:
-
- NH3 (ammin); H2O (aqua, veraltet aquo); CO (carbonyl); NO (nitrosyl)
- Ist die gesamte Koordinationseinheit ein Anion, erhält sie die Endung -at. Für das Zentralatom wird der lateinische Name verwendet (z. B. Argentat, Ferrat, Cuprat, Aurat, Aluminat usw.).
- Ist die Koordinationseinheit neutral oder ein Kation, wird der unveränderte deutsche Name verwendet.
- Die Oxidationszahl (römische Ziffer) des Zentralatoms kommt hinter den Namen des Zentralatoms.
- Beispiele:
-
- [Fe(CN)6]3− Hexacyanidoferrat(III);
- [Cu(NH3)4]2+ Tetraamminkupfer(II);
- [CrCl3(H2O)3] Triaquatrichloridochrom(III);
- [FeBr2(CN)2(H2O)2]2− Diaquadibromidodicyanidoferrat(II)
Bestimmung der Oxidationszahl, Valenzelektronenzahl und Abschätzung der Stabilität
Die Oxidationszahl des Zentralteilchens wird bestimmt, indem man die Gesamtladung des Komplexes und die Ladungen der Liganden betrachtet. Die Summe der Ladungsbeiträge der Liganden und der Oxidationszahl des/der Zentralteilchen muss die Ladung des Komplexes ergeben.
- Einfach negativ geladene Liganden: z. B. Cl−, Br−, Alkyl, Hydrid, Cp;
- Neutrale Liganden: z. B. (Ph)3P, CO, C6H6, Butadien
Die Anzahl der Valenzelektronen ist die Summe der Elektronen der Liganden und des Zentralteilchens, an das die Liganden koordiniert sind.
- Zentralteilchen: z. B. Fe-(0) bringt 8 Elektronen in den Komplex mit ein, weil es in der 8. Nebengruppe steht, Fe-(II) hat demnach 6 in seinen d-Orbitalen.
- Liganden: z. B. bringen Cl− und (Ph)3P zwei Elektronen mit ein, η5-Cp und η6-C6H6 sechs Elektronen, unverbrücktes μ1-CO 2 Elektronen, verbrücktes μ2-CO ein Elektron (ηn, μn: siehe Haptizität)
Eine Abschätzung der Stabilität kann man mit der 18-Elektronen-Regel machen, wenn diese versagt, muss man die Ligandenfeldtheorie oder Molekülorbital-Theorie bemühen.
Geometrie von Komplexen
Die Koordinationszahl gibt an, mit wie vielen sogenannten einzähnigen Liganden sich ein Zentralatom umgibt. Dabei sind freie Elektronenpaare nicht zu vernachlässigen. Besonders häufig sind die Koordinationszahlen 2, 4 und 6.
Ist die Koordinationszahl gleich- zwei, liegt ein linearer Komplex vor;
- drei, erhält man entweder eine trigonal-planare oder eine trigonal-aplanare Struktur (das Zentralteilchen liegt nicht exakt in der Mitte des Dreiecks, sondern leicht darüber);
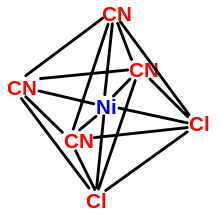
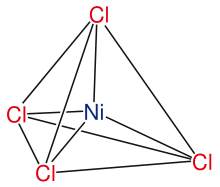
- vier, ergeben die Liganden ein Tetraeder oder eine quadratisch-planare Struktur;
- fünf, ergibt sich eine quadratisch-pyramidale oder trigonal-bipyramidale Struktur. Beide sind durch die Berry-Pseudorotation ineinander überführbar und liegen bei entsprechender Temperatur im Gleichgewicht.
- sechs, ergeben die Liganden ein Oktaeder bzw. ein trigonales Antiprisma oder (seltener) ein trigonales Prisma;
- sieben (sehr selten), erhält man eine pentagonale Bipyramide oder ein einfach überkapptes Oktaeder;
- acht, bilden die Liganden einen Würfel, ein quadratisches Antiprisma oder ein Trigondodekaeder.
Nennenswert ist nur noch die Koordinationszahl 12, die ein Ikosaeder oder ein Kuboktaeder ergibt.
Beispiele:
Koordinationszentrum Ligand Komplex KZ Al3+ F- [AlF6]3- 6 Cr3+ NH3 [Cr(NH3)6]3+ 6 Fe3+ H2O [Fe(H2O)6]3+ 6 Ni CO Ni(CO)4 4 Ag+ CN- [Ag(CN)2]- 2 Symmetrie von Komplexen
siehe Gruppentheorie
Homo- und Heteroleptische Komplexe
Als Homoleptischen Komplex bezeichnet man eine Komplexverbindung, bei der alle Liganden gleichartig sind, andernfalls spricht man von einem heteroleptischen Komplex.
Farbe von Komplexen
Komplexverbindungen sind häufig farbig, da sie über größere delokalisierte Elektronensysteme verfügen. Besonders intensive Färbungen zeigen die Charge-Transfer-Komplexe, wie z. B. Permanganate. Siehe auch Ligandenfeldtheorie. Komplexe, deren Zentralatom ein Hauptgruppenmetall ist, sind in der Regel farblos.
Chelatkomplexe und Zähnigkeit
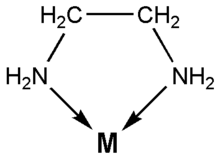
Die Zähnigkeit gibt an, wie viele Bindungen ein Ligand zum Zentralatom ausbilden kann. Liganden, die nur eine Bindung zum Zentralatom ausbilden, werden einzähnig oder monodentat genannt. Ammoniak (NH3, im Komplex als Ammin bezeichnet) ist beispielsweise ein einzähniger Ligand: H3N—M.
Besitzt ein Ligand mehrere Koordinationsstellen, die auch gleichzeitig für die Koordination am gleichen Metallzentrum genutzt werden können, spricht man von einem Chelatliganden (griechisch chelé = Krebsschere). Diese Chelatkomplexe besitzen sowohl thermodynamisch als auch kinetisch eine höhere Stabilität. Die hohe thermodynamische Stabilität beruht auf der Erhöhung der Entropie des Systems, da zur Bildung eines beispielsweise oktaedrischen Komplexes mit einem zweizähnigen Liganden (Ligand mit zwei Koordinationsstellen) in wässriger Lösung folgende Reaktion abläuft:
Hier werden aus vier freien Teilchen (auf der linken Seite) sieben freie Teilchen (auf der rechten Seite). Die kinetische Stabilität beruht darauf, dass sich zur Bildung des Komplexes (nach der kinetischen Gastheorie) weniger Teilchen treffen müssen und bei der Dissoziation alle Bindungen eines Liganden zum Zentralatom gleichzeitig geöffnet werden müssen.
Beispiele für Chelatliganden:
- Ein zweizähniger Ligand ist beispielsweise Ethylendiamin (C2H8N2) (Struktur siehe Abbildung)
- vierzähnige Liganden: z. B. NTA: Nitrilotriessigsäure
- sechszähnige Liganden: z. B. EDTA: Ethylen-diamin-tetraacetat, (−OOC–H2C–)2N–CH2–CH2–N(–CH2–COO−)2. EDTA kann zur Enthärtung von Wasser eingesetzt werden, da es mit Calcium zu leicht löslichen Chelatkomplexen reagiert.
- Andere bedeutende mehrzähnige Liganden sind 2,2'-Bipyridin und Phenanthrolin.
Mehrkernige Komplexe
Mehrkernige Komplexe enthalten mehr als ein Zentralatom. Sie sind über einen Brückenliganden beispielsweise mit Sauerstoff oder Chlor verbunden. Häufig handelt es sich dabei um eine Mehrzentrenbindung.
Cl \ / \ / Rh Rh / \ / \ ClEs gibt jedoch auch Komplexverbindungen mit (z. T. nicht-ganzzahligen) Metall-Metall Mehrfachbindungen, z. B. [Tc2X9]3-, X=Cl, Br.
Komplexstabilität
Harte und weiche Lewis-Säuren und -Basen (HSAB)
Das Konzept der harten und weichen Lewis-Säuren und -Basen (Hard and Soft Acids and Bases) wurde 1963 von Pearson eingeführt.
Die Härte einer Säure nimmt mit abnehmender Größe, zunehmender Ladung und kleinerer Polarisierbarkeit der Säureteilchen zu. Basen sind umso härter, je kleiner, weniger polarisierbar und schwerer oxidierbar die Basenteilchen sind.
Beispiele für Lewis-Säuren:
- Hart: H+, Fe3+, Al3+, Ca2+, Ti4+
- Übergangsbereich: Fe2+, Cu2+, Pb2+, Zn2+
- Weich: Au+, Cu+, Cd2+, Tl+
Beispiele für Lewis-Basen:
- Hart: F−, OH−, O2−, H2O
- Übergangsbereich: Cl−, NH3 , N3−, NO2−
- Weich: I−, Br−, S2−, SCN−
Reaktionen von harten Säuren mit harten Basen und von weichen Säuren mit weichen Basen führen zu stabileren Verbindungen als die Kombinationen weich – hart.
Anwendung des Massenwirkungsgesetzes
Die Lewis-Säure-Base-Reaktionen zur Komplexbildung sind Gleichgewichtsreaktionen, für die das Massenwirkungsgesetz aufgestellt werden kann. Die Gesamtreaktion kann in einzelne Schritte unterteilt werden (sog. Elementarreaktionen), d. h. jeweils für die Anlagerung eines Liganden. Das Produkt der Gleichgewichtskonstanten der einzelnen Elementarreaktionen zur Komplexbildung ergibt dann die Gleichgewichtskonstante für die Gesamtreaktion.
- Beispiele
Die resultierende Konstante nennt man Komplexbildungskonstante. Diese Konstante gibt auch an wie stabil der Komplex ist bzw. ob er zur Dissoziation neigt. Daher wird die Komplexbildungskonstante auch Komplexstabilitätskonstante oder Komplexassoziationskonstante KA genannt. Ihr reziproker Wert wird als Komplexdissoziationskonstante KD bezeichnet, also KA-1 = KD. Je höher die Komplexbildungskonstante, desto stabiler der Komplex, je kleiner, desto leichter ist die Dissoziation.
Theorien zur Bindung
Die Bindung zwischen Zentralatom und Liganden kann durch unterschiedliche Modelle mehr oder weniger umfassend erklärt werden
- Valenzstrukturtheorie (Valence-Bond-Theory, VB-Theorie): Ligandenorbitale überlappen mit unbesetzten Hybrid-Orbitalen des Zentralatoms. Die VB-Therorie erklärt die Geometrie recht gut, aber z. B. nicht die Farbigkeit von Komplexen.
- Kristallfeldtheorie: Die Kristallfeldtheorie geht von reinen elektrostatischen Wechselwirkungen zwischen den Liganden und dem Zentralatom aus. Sie erklärt die Farbigkeit der Komplexe.
- Ligandenfeldtheorie: Die Ligandenfeldtheorie ist eine Erweiterung der Kristallfeldtheorie. Sie untersucht den Einfluss der punktförmigen Liganden auf die Energien der d-Orbitale des Zentralmetalls. (Siehe auch: Jahn-Teller-Effekt).
- Molekülorbitaltheorie: Die Molekülorbitaltheorie liefert die beste Beschreibung von Komplexverbindungen da sie sowohl das Zentralatom als auch die Liganden quantenmechanisch behandelt.
Anwendung und Bedeutung
Biologische Bedeutung
Auch in der Biologie spielen Komplexe eine wichtige Rolle. Es kann sich dabei um katalytisch aktive Proteine (Enzyme) oder katalytisch nicht aktive Proteine handeln. Zahlreiche Enzyme enthalten Komplexe in ihren aktiven Zentren. Dieses Thema ist eines der Schwerpunktgebiete der bioanorganischen Chemie. Im Allgemeinen liegt hierbei ein komplexierendes Metallatom vor, welches nicht vollständig durch Aminosäureseitenketten als Liganden komplexiert ist. Eine Ligandenstelle fungiert als aktives Zentrum zur Umsetzung oder temporären Bindung des Substrats. Häufigste Komplexzentren sind dabei Eisen, Kupfer, Zink, Calcium, Magnesium und Mangan. Es kommen aber auch ungewöhnlichere Elemente wie Vanadium vor. Insbesondere Calcium, wie auch Zink-Komplexe haben eine strukturelle Bedeutung (z. B. Zinkfinger bei der DNA-Sequenzerkennung). Bei den katalytisch nicht aktiven Proteinen finden sich z. B. Porphyrinkomplexe wie das Häm im Hämoglobin und in Cytochromen, oder das Chlorophyll (jeweils Chelatkomplexe).
Siehe auch:
- Nonactin
- Ionophore
- Siderophore
- Valinomycin
- Gramicidin
Komplexbildner
Diverse Komplexbildner dienen als Lebensmittelzusatzstoffe, als Additiv in der Wasch- und Reinigungsmittelindustrie, in der Galvano- und Leiterplattenindustrie sowie in der chemischen Analytik.
- EDTA als universeller harter Komplexbildner sowie Calcium-Dinatrium-EDTA (E 385) für die Lebensmittelindustrie
- Gluconsäure (E 574 bei Lebensmitteln), auch bei Reinigern und in der Galvanotechnik
- Isoascorbinsäure (E 315)
- Natriumisoascorbat (E 316)
- Weinsäure (E 334)
- Zitronensäure (E 330) und ihre Salze Natriumcitrat (E 331), Kaliumcitrat (E 332) und Calciumcitrat (E 333)
- Iminodisuccinat Tetranatriumsalz - Dieser besonders gut biologisch abbaubare Komplexbildner wird in Wasserkreisläufen zur Verhinderung und Auflösung von Kalkablagerungen verwendet.
- Triethanolamin
- 1,4,7,10-Tetraazacyclododecan-1,4,7,10-tetraessigsäure (DOTA) als Komplexbildner in der Nuklearmedizin (beispielsweise in Edotreotid) und in der Magnetresonanztomographie (als Gadotersäure).
In der analytischen Chemie werden Komplexbildungsreaktionen mit bestimmten Komplexbildnern zum Nachweis für Kupfer-, Silber-, Nitrat-/Ringprobe, Bismut-Ionen u.v.m. genutzt. Siehe dazu Chelatometrie.
Technische Anwendungen
Als Katalysatoren in vielen chemischen Reaktionen.
Phthalocyanin-Komplexe werden in CDs als Speichermedium verwendet.
In der analogen Fotografie wird nach der Entwicklung das verbliebene, unbelichtete, in Wasser kaum lösliche Silberbromid mit Fixiersalz-Lösung (Ammonium- oder Natriumthiosulfat) aus der Schicht gelöst: siehe Fixieren (Fotografie).
Siehe auch
- Liste der Liganden-Abkürzungen
- 18-Elektronen-Regel
- Kristallfeldtheorie, Ligandenfeldtheorie
- Valenzstrukturtheorie
- Schwach koordinierende Ionen
- Oberflächenkoordinationschemie
Literatur
- Henry Taube: Elektronenübertragung zwischen Metallkomplexen – ein Rückblick (Nobel-Vortrag). In: Angewandte Chemie 96(5), S. 315–326 (1984), ISSN 0044-8249.
- Elemente Chemie II . Klett, S. 139, ISBN 3-12-759800-9.
- Charles E. Mortimer: Chemie - Das Basiswissen der Chemie. Georg Thieme, 2010, S. 513, ISBN 978-3-13-484310-1.
Weblinks
 Wikibooks: Allgemeine und Anorganische Chemie/ Komplexe – Lern- und Lehrmaterialien
Wikibooks: Allgemeine und Anorganische Chemie/ Komplexe – Lern- und Lehrmaterialien- http://www.ddesignmedia.de/Library2/ErsteSeite.htm
- http://www.cci.ethz.ch/vorlesung/de/al1/node16.html
- http://www.uni-giessen.de/~ge1016/skripte/ac1/ac1_kapitel5.pdf (PDF-Datei; 455 kB)
- Cambridge Structural Database
- 2D-Komplexe auf einer Graphitoberfläche dargestellt mit einem Rastertunnelmikroskop
- Sehr umfangreiche, interaktiv sortierbare Liste mit Komplexbildungskonstanten
Einzelnachweise
- ↑ IUPAC Red Book 2005, s. Section IR-9.2.2.3 für Komplexe
- ↑ Erwin Riedel, Anorganische Chemie 6. Auflage; Walter de Gruyter- Berlin . New York 2004
Kategorien:- Teilgebiet der Chemie
- Komplexchemie
Wikimedia Foundation.


![\mathrm{CuSO_4 + 6 \ H_2O \longrightarrow [Cu(H_2O)_6]^{2+} \ + \ SO_4^{2-}}](8/108729976b5fe294001c9bd6850ea4c4.png)

![\mathrm{[M(H_2O)_6] + 3 \ X \longrightarrow [MX_3] + 6 \ H_2O}](c/88c3dab4e1f968490f467017b83af571.png)
![\mathrm{Ni^{2+} + CN^- \rightleftharpoons [NiCN]^+} \quad\quad K_1 = \mathrm{\frac{[[Ni(CN)]^+]}{[Ni^{2+}] \cdot [CN^-]}}](e/ade36c7286b76a04c17e20b7f9f3bffc.png)
![\mathrm{[Ni(CN)]^+ + CN^- \rightleftharpoons [Ni(CN)_2]} \quad\quad K_2 = \mathrm{\frac{[[Ni(CN)_2]]}{[Ni(CN)]^+ \cdot [CN^-]}}](5/375512888d1698828b1b7c73ce421f6a.png)
![\mathrm{[Ni(CN)_2] + CN^- \rightleftharpoons [Ni(CN)_3]^-} \quad\quad K_3 = \mathrm{\frac{[[Ni(CN)_3]^-]}{[Ni(CN)_2] \cdot [CN^-]}}](5/2e54ebf23752f421c155cb6bb4b897ac.png)
![\mathrm{[Ni(CN)_3]^- + CN^- \rightleftharpoons [Ni(CN)_4]^{2-}} \quad\quad K_4 = \mathrm{\frac{[[Ni(CN)_4]^{2-}]}{[Ni(CN)_3^-] \cdot [CN^-]}}](6/4568d1a637120e90cf3f4fa2a7d2362f.png)