- G-Protein-gekoppelter Rezeptor
-
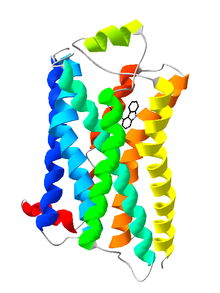
 Bändermodell des G-Protein-gekoppelten Rezeptors Rhodopsin.
Bändermodell des G-Protein-gekoppelten Rezeptors Rhodopsin.
Der Begriff G-Protein-gekoppelter Rezeptor (kurz GPCR, für englisch G protein-coupled receptor) wird in der Biologie für Rezeptoren in der Zellmembran verwendet, die Signale über GTP-bindende Proteine (kurz G-Proteine) in das Zellinnere weiterleiten (Signaltransduktion). Diese stellen die größte und vielseitigste Gruppe von Membranrezeptoren dar. In der Neurobiologie wird für G-Protein-gekoppelte Rezeptoren häufig der Begriff metabotrope Rezeptoren verwendet, um sie von einem anderen Rezeptortyp, den ligandengesteuerten Ionenkanälen (Ionotroper Rezeptor), zu unterscheiden.
G-Protein-gekoppelte Rezeptoren sind für die Verarbeitung von Licht-, Geruchs- und einer Vielzahl von Geschmacksreizen verantwortlich. Sie spielen eine entscheidende Rolle bei Entzündungsprozessen, der gezielten Zellbewegung (Taxis), dem Transport von Stoffen durch die Zellmembran (Endozytose und Exozytose) sowie beim Zellwachstum und bei der Zelldifferenzierung. Sie sind darüber hinaus als Zielstrukturen für die Wirkung von Hormonen, wie Adrenalin oder Glucagon, und Neurotransmittern, wie Serotonin und Acetylcholin, verantwortlich. Auch einige Viren nutzen G-Protein-gekoppelte Rezeptoren als Bindungsstellen für den Eintritt in die Zelle (beispielsweise HIV).
Inhaltsverzeichnis
Definition
Als G-Protein-gekoppelte Rezeptoren im engeren Sinn werden alle heptahelikalen, das heißt mit 7 Helices in der Zellmembran verankerten Rezeptoren bezeichnet, die zur Bindung und Aktivierung von G-Proteinen befähigt sind. Zusätzlich zur Bindung von G-Proteinen sind viele dieser Rezeptoren in der Lage, auch mit anderen signalweiterleitenden Proteinen zu interagieren. Als G-Protein-gekoppelte Rezeptoren werden, wie im Fall vieler sogenannter "Orphan-GPCRs", auch Rezeptorproteine bezeichnet, für die eine Kopplung mit G-Proteinen lediglich vermutet wird. Bisweilen wird dieser Begriff auch auf Rezeptoren angewandt, die zwar nicht zur Bindung und Aktivierung von G-Proteinen befähigt sind, jedoch auf Grund ihrer phylogenetischen Verwandtschaft mit anderen, der klassischen Definition genügenden G-Protein-gekoppelten Rezeptoren dieser Familie zugerechnet werden können.
Dem gegenüber werden prokaryotische Rhodopsine, die zwar in ihrer Struktur eukaryotischen G-Protein-gekoppelten Rezeptoren ähneln, aber nicht zur Bindung von G-Proteinen befähigt sind und als Ionenkanäle fungieren, nicht der Familie der G-Protein-gekoppelten Rezeptoren zugeordnet.
Vorkommen
G-Protein-gekoppelte Rezeptoren kommen in fast allen Lebewesen vor, nicht nur in Wirbeltieren und Wirbellosen, sondern auch in Protozoen (z. B. Amöben) und in Pilzen (beispielsweise in Hefen). Auch im Pflanzenreich konnte das Vorkommen G-Protein-gekoppelter Rezeptoren am Beispiel der Acker-Schmalwand und des Reis nachgewiesen werden. Hier wird eine Rolle als Rezeptor für Phytohormone diskutiert. Einige Fotorezeptoren mit einer Struktur, die G-Protein-gekoppelten Rezeptoren ähnelt, können sogar in Archaeen gefunden werden (Bacteriorhodopsine). Diese Rezeptoren haben jedoch keine Verwandtschaft zu Fotorezeptoren höherer Tiere und werden in der Regel nicht der Familie der G-Protein-gekoppelten Rezeptoren zugerechnet.
Beim Menschen konnten bisher etwa 800 G-Protein-gekoppelte Rezeptoren identifiziert werden. Diese werden durch etwa 3 % des menschlichen Genoms kodiert. Mehr als die Hälfte der G-Protein-gekoppelten Rezeptoren des Menschen werden den Geruchsrezeptoren (olfaktorischen Rezeptoren) zugeordnet. Bei über 140 der ca. 800 G-Protein-gekoppelten Rezeptoren ist der endogene Ligand nicht bekannt und sie werden deshalb als Orphan-GPCRs bezeichnet.[1]
Struktur
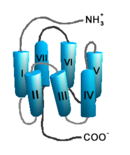
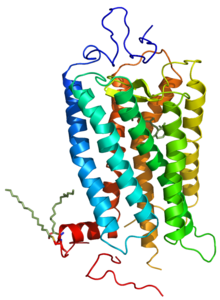
Auf Grund ihrer Struktur gehören G-Protein-gekoppelte Rezeptoren der Superfamilie der heptahelikalen Transmembranproteine (gebräuchliche Synonyme: Sieben-Transmembrandomänen-Rezeptoren, 7-TM-Rezeptoren und heptahelikale Rezeptoren) an. Sie bestehen aus Untereinheiten mit sieben (griechisch „hepta“) die Zellmembran durchspannenden (transmembranären) Helixstrukturen, die durch drei intrazelluläre und drei extrazelluläre Schleifen miteinander verbunden sind. G-Protein-gekoppelte Rezeptoren besitzen eine extrazelluläre oder transmembranäre Bindungsdomäne für einen Liganden. Das G-Protein bindet an der zellinneren (intrazellulären) Seite des Rezeptors.
Lange Zeit war nur die Struktur von GPCRs bei Bakterien bekannt. Die dreidimensionale Strukturaufklärung eines G-Protein-gekoppelten Rezeptors bei Vertebraten, des bovinen Rhodopsins, gelang im Jahr 2000 mit Hilfe der Röntgenstrukturanalyse [2]. Die Kristallisierung und Strukturaufklärung anderer G-Protein-gekoppelter Rezeptoren ist hingegen wegen ihrer physikochemischen Eigenschaften und aufgrund der geringen Rezeptordichte in der Membran erschwert. Daher konnte erst im Jahr 2007 die Kristallstruktur eines ligandenaktivierten G-Protein-gekoppelten Rezeptors (menschlicher β2-Adrenozeptor) aufgeklärt werden [3]. Inzwischen gilt die dreidimensionale Struktur zahlreicher G-Protein-gekoppelter Rezeptoren, darunter die des β1-Adrenozeptors[4], des A2A-Adenosinrezeptors[5], des D3-Dopaminrezeptors[6] und des Chemokinrezeptors CXCR4[7], als aufgeklärt. Zudem ist noch mit dem Rhodopsin des japanischen Fliegenden Kalmars die Struktur eines G-Protein-gekoppelten Rezeptors bei Invertebraten bekannt.[8]
Transmembrandomänen
Die sieben membrandurchspannenden helikalen Domänen G-Protein-gekoppelter Rezeptoren, die bei Sicht auf den Rezeptor von der extrazellulären Seite aus entgegen dem Uhrzeigersinn angeordnet sind, sind für die Verankerung des Rezeptors in der Zellmembran verantwortlich. Insbesondere die Transmembrandomänen III–VI beherbergen Bindungsstellen für einen Liganden. Den Transmembrandomänen I, II und IV kommt möglicherweise eine Rolle bei der Di- und Oligomerisierung von G-Protein-gekoppelten Rezeptoren zu.
Im Gegensatz zu den extrazellulären und intrazellulären Domänen sind die Transmembrandomänen innerhalb der Familie G-Protein-gekoppelter Rezeptoren stark konserviert. Einige Aminosäuresequenzen (Motive) innerhalb der Transmembrandomänen sind für viele G-Protein-gekoppelte Rezeptoren charakteristisch. Beispielsweise können das E/DRY-Motiv der Transmembrandomäne III und das NPxxY-Motiv der Transmembrandomäne VII in fast allen Rhodopsin-ähnlichen Rezeptoren gefunden werden. Ihnen wird eine wichtige Rolle bei der Rezeptoraktivierung zugeschrieben.
Extrazelluläre Domänen
Einige G-Protein-gekoppelte Rezeptoren, wie z. B. die metabotropen Glutamatrezeptoren, besitzen in ihrer extrazellulären N-terminalen Domäne ihre primäre Ligandenbindungsstelle. Diese Rezeptoren sind durch lange N-terminale Aminosäuresequenzen gekennzeichnet (bis 2800 Aminosäuren), während Rezeptoren mit intrazellulären Ligandenbindungsdomänen meist nur kurze Reste aufweisen (meist unter 30 Aminosäuren). Der N-Terminus und die extrazellulären Domänen des Rezeptors sind häufig glykosyliert. In der zweiten extrazellulären Schleife (EL 2) und am Anfang der dritten transmembranären Domäne des Rezeptors befinden sich zwei konservierte, zur Disulfidbrückenbildung befähigte Cysteine, welche die Struktur des Rezeptors stabilisieren, indem sie die Transmembrandomänen III bis V aneinander binden.
Intrazelluläre Domänen
Die intrazelluläre Seite des Rezeptors ist mit Bindungsstellen für G-Proteine und andere Signalmoleküle ausgestattet. An der Bindung von G-Proteinen sind insbesondere die transmembrandomänennahen Aminosäuren der zweiten (IL2) und dritten intrazellulären Schleife (IL 3) sowie der sich an die 7. transmembranäre Domäne anschließende C-terminale Rest, beteiligt. Der intrazelluläre C-terminale Anteil ist in der Regel sehr kurz (meist unter 50 Aminosäuren). Einigen G-Protein-gekoppelten Rezeptoren, wie beispielsweise dem Gonadotropin-Releasing-Hormon-Rezeptor, fehlt dieser Teil. Direkt an das intrazelluläre Ende der 7. transmembranären Domäne kann sich auch noch eine mit einem konservierten Cystein beginnende achte Helix (Hx 8) anschießen, die parallel zur Zellmembran verläuft.
Funktion
Die Hauptfunktion der G-Protein-gekoppelten Rezeptoren besteht in der Weiterleitung von Signalen in das Zellinnere. Diese Signalweiterleitung (Signaltransduktion) geschieht insbesondere über die Aktivierung von G-Proteinen. Einige G-Protein-gekoppelte Rezeptoren sind auch zu einer G-Protein-unabhängigen Signaltransduktion, beispielsweise über Arrestine, befähigt.
Aktivierung von G-Proteinen
Nahezu alle G-Protein-gekoppelten Rezeptoren sind zu einer direkten Aktivierung eines aus drei Untereinheiten (α, β und γ) bestehenden (heterotrimeren) G-Proteins befähigt. Die Aktivierung eines G-Proteins ist ein mehrstufiger Prozess, der die Bindung eines Liganden an den Rezeptor, die Konformationsänderung des Rezeptors sowie die Bindung und Aktivierung eines G-Proteins einschließt und dabei den Gesetzen der Thermodynamik unterliegt.
Schritt 1: Bindung des G-Proteins
Aktivierte Rezeptoren interagieren mit heterotrimeren G-Proteinen, die dadurch selbst aktiviert werden. Der Rezeptor zeigt dabei eine Selektivität für ein (beispielsweise β1-Adrenozeptor: Gs) oder für mehrere verschiedene (z. B. β2-Adrenozeptor: Gs und Gi/o) G-Proteinsubtypen. Dieser Komplex aus Rezeptor und heterotrimeren G-Protein ist dabei ein Bestandteil eines größeren Netzwerks, an dem auch weitere signalweiterleitende Proteine, wie z. B. GIRK-Kanäle, Phospholipase C und Proteinkinase C beteiligt sind[9]. Mit Hilfe dieses Netzwerks kann eine schnelle, oft nur Millisekunden bis wenige Sekunden dauernde Aktivierung der Signaltransduktionskaskade G-Protein-gekoppelter Rezeptoren erklärt werden. Ob der Rezeptor mit dem G-Protein durch Kollisionskopplung interagiert, oder ob Rezeptoren auch im inaktiven Zustand mit dem G-Protein assoziiert sind ist Gegenstand aktueller Forschung[10].
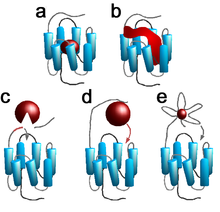
Schritt 2: Ligandenbindung
Abhängig von der Art des Liganden erfolgt die Bindung an den Rezeptor an seine extrazellulären, transmembranären oder intrazellulären Domänen:
- Der Ligand All-trans-Retinal ist fester transmembranärer Bestandteil des Lichtrezeptors Rhodopsin (Abb. a).
- Amine (z. B. Acetylcholin, Adrenalin, Histamin und Serotonin), Nucleotide (z. B. ATP), Eikosanoide (z. B. Prostacyclin) und einige Lipide (z. B. Ceramide) binden an transmembranäre Bindungsstellen ihrer Rezeptoren (Abb. a).
- Neuropeptide (z. B. Oxytocin und Vasopressin) besetzen mehrere transmembranäre und extrazelluläre Bindungsstellen ihrer Rezeptoren gleichzeitig (Abb. b).
- Proteinasen (z. B. Thrombin und Trypsin) spalten spezifisch ein kurzes N-terminales Fragment ihrer Rezeptoren, den Protease-aktivierten Rezeptoren, ab. Durch die proteolytische Spaltung wird ein intrinsischer Ligand ("tethered ligand") am neu entstehenden Rezeptor-N-Terminus freigelegt, welcher sich in einem zweiten Schritt an eine transmembranäre Bindungsstelle anlagert (Abb. c) [11].
- Proteohormone (z. B. Glucagon) binden primär an extrazelluläre Domänen des Rezeptors. Nach einer Konformationsänderung des Rezeptors erfolgt eine sekundäre Bindung des Peptidhormons an transmembranäre Bindungsstellen (Abb. d).
- Einige kleine Moleküle (z. B. Glutamat und Calcium) binden ausschließlich an extrazellulären Rezeptordomänen. Durch die Anbindung des Liganden ändert sich die Konformation der extrazellulären Domänen, so dass diese mit intrazellulären Domänen in Kontakt kommen (Abb. e).
Schritt 3: Aktivierung des Rezeptors
Bindet an einen Rezeptor ein Ligand und wird dieser durch den Liganden aktiviert (Agonist), so führt diese Anlagerung meist zu einer Sprengung der Salzbrücke zwischen der 3. und der 7. transmembranären Domäne des G-Protein-gekoppelten Rezeptors. Dieser so aktivierte Rezeptor erhält mehr Flexibilität und ändert seine dreidimensionale Struktur. Durch die Änderung der Konformation des Rezeptors kann dieser jetzt als GTP-Austauschfaktor (GTP exchange factor, GEF) für das gebundene G-Protein fungieren.
Viele G-Protein-gekoppelte Rezeptoren befinden sich bereits in Abwesenheit eines Agonisten in einem Gleichgewicht zwischen inaktivem und aktiviertem Zustand. Die Anbindung eines Agonisten verschiebt das Gleichgewicht in Richtung aktiver Zustand, während inverse Agonisten das Gleichgewicht in Richtung inaktiver Zustand verschieben. Rezeptoren, die sich auch in Abwesenheit eines Agonisten in einem aktivierten Zustand befinden können nennt man konstitutiv aktiv. Auch Mutationen im Rezeptor können eine konstitutive Aktivität bewirken („Constitutive active mutants“, CAM). Derartig mutierte G-Protein-gekoppelte Rezeptoren werden mit bestimmten Erkrankungen (z. B. bestimmte Formen von Retinopathia pigmentosa durch konstitutiv aktives Rhodopsin) in Verbindung gebracht und kommen in bestimmten Herpesviren vor. Weiterhin werden in der experimentellen Pharmakologie inzwischen G-Protein-gekoppelte Rezeptoren auch gezielt zu CAMs verändert, um diese bei der Suche nach neuen Medikamenten zu verwenden.
Schritt 4: Aktivierung der G-Proteine
Heterotrimere G-Proteine können GTP und GDP binden, die GDP-gebundene Form ist inaktiv. Die Aktivierung des Rezeptors sorgt für den Austausch von GDP gegen GTP an der α-Untereinheit des G-Proteins. Der G-Protein-Komplex wird durch die Bindung des GTP instabil. Als Folge ändert sich die Konformation des heterotrimeren G-Proteins und es kann in die α- und die βγ-Untereinheit dissoziieren. Die aktivierten G-Proteine können nun die exogenen, durch den Liganden übertragenen Signale in das Zellinnere weiterleiten (Signaltransduktion).
Schritt 5: Signaltransduktion
Die aktivierten Untereinheiten des G-Proteins sind für die weitere Signaltransduktion verantwortlich. Je nach Untereinheit werden weitere zell- oder membranständige Proteine aktiviert oder deaktiviert. So modulieren beispielsweise die α-Untereinheiten der Gs/olf die Aktivität der Adenylylcyclase, während α-Untereinheiten der Gq/11-Proteine die Phospholipase C aktivieren. Diese Enzyme sind dann an der Bildung eines Second Messengers beteiligt.
Schritt 6: G-Protein-Inaktivierung
Die intrinsische GTPase-Aktivität der α-Untereinheit des G-Proteins spaltet nach einer Zeit und unter Mithilfe von Proteinen, die die GTPase-Aktivität erhöhen (GTPase aktivierendes Protein, GAP), das gebundene GTP in GDP + Pi. Die α-Untereinheit des G-Proteins kann somit wieder mit der βγ-Untereinheit reassoziieren und erneut an einen Rezeptor binden (siehe Schritt 1). Es findet also eine Selbstregulierung statt.
Alternative Signaltransduktionswege
Viele G-Protein-gekoppelte Rezeptoren sind nicht nur zu einer Aktivierung von G-Proteinen, sondern auch zu einer Bindung und Aktivierung anderer, Zellprozesse steuernder Moleküle befähigt. Auf diese Weise können G-Protein-gekoppelte Rezeptoren G-Protein-unabhängig alternative Signaltransduktionswege steuern. Beispiele hierfür sind die Frizzled-Rezeptoren, die über den Wnt-Singnalweg β-Catenin aktivieren können, der β2-Rezeptor, der G-Protein-unabhängig die Funktion des Na+/H+-Austauschers modulieren kann und der 5-HT2B-Rezeptor, dessen eNOS aktivierende Funktion zumindest teilweise ebenfalls G-Protein-unabhängig ist. Durch G-Protein-unabhängige Aktivierungen von Arrestin und Homer-Proteinen kann darüber hinaus die Funktion G-Protein-gekoppelter Rezeptoren selbst reguliert werden.
Regulierung der Rezeptorfunktion
Für die Funktion von G-Protein-gekoppelten Rezeptoren ist deren Lokalisation an der Zelloberfläche Voraussetzung. Zelluläre Prozesse, die zu einer Erhöhung der Rezeptorzahl an der Zellmembran und damit der Rezeptorfunktion führen, werden als Up-Regulation bezeichnet. Im Gegensatz dazu stellt die Entfernung funktionstüchtiger Rezeptoren von der Zellmembran (Down-Regulation) einen Mechanismus der Beendigung der Rezeptorfunktion dar.
Up-Regulation
Die Heraufregulierung („Up-Regulation“) G-Protein-gekoppelter Rezeptoren ist ein mehrstufiger Prozess. Ausgangspunkt ist die Proteinbiosynthese des Rezeptors am endoplasmatischen Reticulum, die unter anderem durch G-Protein-gekoppelte Rezeptoren indirekt reguliert werden kann.
Der Transport des so synthetisierten Rezeptors über Golgi-Vesikel zur Zellmembran kann durch Chaperone und Chaperon-ähnliche Proteine einschließlich Rezeptoraktivität-modifizierender Proteine gesteuert werden. Eine Regulation des Membrantransports ist ebenfalls durch eine Glykosylierung des Rezeptors möglich. Eine Bedeutung der für viele G-Protein-gekoppelte Rezeptoren beobachteten Di- und Oligomerisierung als Voraussetzung für deren Transport zur Zellmembran und somit für deren Funktionalität wird ebenfalls diskutiert. Der Einbau der G-Protein-gekoppelten Rezeptoren in die Zellmembran kann beispielsweise durch Homer-Proteine, PSD-95 und Spinophilin gesteuert werden.[12]
Down-Regulation
Die durch G-Protein-gekoppelte Rezeptoren vermittelten Effekte nehmen nach längerer Zeit der Aktivierung ab. Eine Schlüsselrolle dieser Herabregulierung („Down-Regulation“) spielt dabei die Phosphorylierung intrazellulärer Domänen des Rezeptors (C-terminale Serin- oder Threonin-Reste) durch Proteinkinasen.
Phosphorylierung durch Second-Messenger-aktivierte Kinasen
Proteinkinasen, die über G-Protein-vermittelte Produktion von Second Messengern (sekundären Botenstoffen) aktiviert werden (wie beispielsweise die durch cyclisches Adenosinmonophosphat (cAMP) aktivierte Proteinkinase A oder die durch Diacylglycerol und Calcium aktivierte Proteinkinase C), können viele G-Protein-gekoppelte Rezeptoren phosphorylieren. Häufig wird dadurch die Signaltransduktion über den Rezeptor unterbrochen, da der phosphorylierte Rezeptor eine geringere Affinität zu G-Proteinen besitzt. Diese Regulation kann demzufolge als ein negativer Rückkopplungs-Mechanismus wirken.
Phosphorylierung durch G-Protein-gekoppelte Rezeptorkinasen
G-Protein-gekoppelte Rezeptorkinasen (kurz GRKs) haben im Wesentlichen zwei Funktionen. Erstens können sie mit den Gα- und Gβγ-Untereinheiten der heterotrimeren G-Proteine interagieren, womit diese nicht mehr zur Signaltransduktion beitragen. Außerdem können sie als GAP (GTPase-aktivierendes Protein) wirken und die Umwandlung von GTP*Gα zu GDP*Gα beschleunigen. Zweitens sind sie Serin-/Threonin-Kinasen und können als solche G-Protein-gekoppelte Rezeptoren phosphorylieren.
Folgen der Phosphorylierung
- Konformationsänderung des Rezeptors: durch die stark negative Ladung des Phosphatrests und damit einhergehende elektrostatische Wechselwirkungskräfte ändert sich die Konformation des Rezeptors. Die neue Konformation ist oft ungünstiger für die Rezeptor-G-Protein-Interaktion oder beeinflusst die Affinität des Rezeptors, so dass es zu einer Abschwächung des Rezeptorsignals kommt. Diese Art der Desensitivierung erfolgt oft durch die Second-Messenger-abhängigen Proteinkinasen A und C.
- Interaktion mit beta-Arrestinen: Durch Bindung von Arrestin an den vor allem durch GRKs phosphorylierten Rezeptor wird sterisch eine Anbindung der G-Proteine verhindert (= Kurzzeitregulation innerhalb weniger Minuten). Außerdem dienen die beta-Arrestine als „scaffold“-Moleküle für eine Vielzahl weiterer Proteine, besonders hervorzuheben sind dabei Clathrin und die MAP-Kinasen.
- Internalisierung: Die Bindung des Rezeptor-Arrestin-Komplexes an Clathrin führt zur Entfernung des phosphorylierten Rezeptors von der Zelloberfläche ins Zellinnere in Form von Membranvesikeln (clathrin-coated pits). Nachfolgend kann der Rezeptor intrazelluär abgebaut, recycelt und damit an die Oberfläche zurückgebracht werden oder auch als intrazellulärer Rezeptor fortbestehen. Diese Regulation erfolgt meist innerhalb von 10 bis 30 Minuten und wird nach Entfernung des Rezeptorstimulus oft innerhalb von 30 bis 60 Minuten rückgängig gemacht. Eine langfristige Regulation über Tage oder Monate ist oft auf Transkriptionsregulation zurückzuführen.
Die Bindung von MAP-Kinasen an den Rezeptor-Arrestin-Komplex führt dazu, dass diese nicht mehr über G-Proteine, sondern direkt vom Rezeptor stimuliert werden. Dieser Wechsel des Signaltransduktionsmechanismus erfolgt ebenfalls innerhalb von etwa zehn Minuten.
Einteilung
Klassifizierung nach Funktion
Eine erste systematische Klassifizierung der G-Protein-gekoppelten Rezeptoren erfolgte Anfang der 1990er Jahre anhand funktioneller Merkmale. Anhand dieses Systems wurden die G-Protein-gekoppelten Rezeptoren von Wirbeltieren und Wirbellosen in fünf Gruppen (A-E) unterteilt. Die Gruppe A repräsentierten mit Rhodopsin verwandte Rezeptoren, Glycoproteinrezeptoren wurden in die Gruppe B und die metabotropen Glutamatrezeptoren in die Gruppe C eingeteilt. Rezeptoren der Gruppen D und E kommen nicht bei Wirbeltieren vor. Sie fungieren als Pheromonrezeptoren in Hefen bzw. als cAMP-Rezeptoren in Nematoden.
Mit der Entdeckung neuer G-Protein-gekoppelter Rezeptoren wurde dieses System in den letzten Jahren erweitert. Außerhalb des oben beschriebenen ABCDE-Systems wurden eigene Gruppen für die MLO-Rezeptoren der Pflanzen, für die Geruchsrezeptoren der Insekten, für die Chemorezeptoren der Nematoden und für die „Frizzeled/Smoothened“-Rezeptoren höherer Tiere etabliert.[13]
Ein neues System der Klassifizierung der humanen G-Protein-gekoppelten Rezeptoren wurde basierend auf phylogenetischen Untersuchungen vorgeschlagen (GRAFS- oder Fredriksson-System). Diesem System zufolge werden G-Protein-gekoppelte Rezeptoren in fünf Hauptgruppen unterteilt: in die Glutamat-, Rhodopsin-, Adhäsions-, Frizzled/Taste2- und Secretin-Gruppe[14].
Einteilung nach intrinsischer Wirkung
Vor allem in der Pharmakologie werden G-Protein-gekoppelte Rezeptoren nach ihrer intrinsischen Aktivität in 3 Klassen eingeteilt:
- Gs-gekoppelte Rezeptoren: Bei Aktivierung wird durch das G-Protein die Adenylatcyclase aktiviert und es wird vermehrt cAMP gebildet.
- Gi-gekoppelte Rezeptoren: Bei Aktivierung wird durch das G-Protein die Adenylatcyclase gehemmt und es wird weniger cAMP gebildet.
- Gq-gekoppelte Rezeptoren: Bei Aktivierung wird durch das G-Protein die Phospholipase C aktiviert, welche wiederum ein Phospholipid in Inositoltriphosphat (IP3) und Diacylglycerol (DAG) spaltet.
Bedeutung der G-Protein-gekoppelten Rezeptoren für die Medizin
Arzneistoffe
In der modernen Medizin nehmen G-Protein-gekoppelte Rezeptoren eine Schlüsselposition ein: etwa 60 % aller verschreibungspflichtigen Medikamente, die derzeit auf dem Markt sind, wirken auf G-Protein-gekoppelte Rezeptoren ein. Unter diesen Medikamenten befinden sich unter anderem die häufig verschriebenen Betablocker, Neuroleptika, Antihistaminika, Opioide und Sympathomimetika. Neue, über G-Protein-gekoppelte Rezeptoren wirkende Medikamente, wie beispielsweise die Triptane, Setrone und Sartane, haben in den letzten Jahren ebenfalls einen hohen Stellenwert erreicht.
Beispiele für den therapeutischen Einsatz von Arzneimitteln, die an G-Protein-gekoppelten Rezeptoren wirken Arzneistoff Beispiele Indikation Rezeptor(en) Kopplung Erläuterungen Clonidin Arterielle Hypertonie α2-Adrenozeptoren Gi Senken als Agonisten an α2-Adrenozeptoren im Zentralnervensystem die Aktivität des Sympathikus und reduzieren darüber den Blutdruck. Alphablocker Prazosin, Tamsulosin Arterielle Hypertonie, Prostatahyperplasie α1-Adrenozeptoren Gq Senken als Antagonisten an α1-Adrenozeptoren den Tonus der glatten Muskulatur in Blutgefäßen und im Urogenitaltrakt. Anticholinergika Atropin Harninkontinenz, Asthma bronchiale, bradykarde Herzrhythmusstörungen Muscarinische Acetylcholinrezeptoren Gi & Gq Senken als Antagonisten an Muskarin-Rezeptoren den Tonus der glatten Muskulatur in Bronchien und im Urogenitaltrakt. Hemmen die Herzfrequenz-senkende Wirkung von Acetylcholin. Betablocker Atenolol, Metoprolol Arterielle Hypertonie, Herzinsuffizienz, koronare Herzkrankheit, Migräne β1-Adrenozeptoren Gs Senken als Antagonisten an β1-Adrenozeptoren unter anderem die Herzfrequenz. Dopamin-Agonisten Pergolid, Cabergolin, Pramipexol, Ropinirol Parkinson-Krankheit, Restless-Legs-Syndrom Dopamin-Rezeptoren Gi & Gs Imitieren als Agonisten an Dopaminrezeptoren die Wirkung des Dopamins. H1-Antihistaminika Diphenhydramin, Loratadin, Cetirizin Allergische Reaktionen H1-Rezeptoren Gq Hemmen als Antagonisten die Wirkung von Histamin, das bei allergischen Reaktionen ausgeschüttet wird, an H1-Rezeptoren. H2-Antihistaminika Ranitidin, Famotidin, Cimetidin Kontrolle der Magensäureproduktion (Refluxkrankheiten, Magengeschwür) H2-Rezeptoren Gs Hemmen als Antagonisten an H2-Rezeptoren die Histamin-vermittelte Freisetzung von Magensäure. Neuroleptika Haloperidol, Risperidon, Clozapin, Olanzapin Schizophrenie D2-Rezeptoren, 5-HT2A-Rezeptoren Gi & Gq Führen über eine vorrangige Hemmung von D2-Rezeptoren (typische Neuroleptika) oder 5-HT2A-Rezeptoren (atypische Neuroleptika) zu einer antipsychotischen Wirkung. Opioide Morphin, Codein, Fentanyl, Loperamid Schmerzen, Anästhesie, Husten, Durchfall Opioidrezeptoren Gi Führen als Agonisten an den Opioidrezeptoren μ,κ und δ zu einer spinalen und supraspinalen Analgesie sowie zu einer zentralen Hemmung des Hustenreizes. AT1-Antagonisten Losartan, Candesartan, Irbesartan, Valsartan, Telmisartan Hypertonie, Herzinsuffizienz, koronare Herzkrankheit Angiotensins II an AT1-Rezeptoren den Tonus der glatten Muskulatur in Blutgefäßen. Triptane Sumatriptan, Naratriptan, Zolmitriptan Migräne 5-HT1B-Rezeptoren Gi Migränetherapeutische Wirkung über eine Stimulation von 5-HT1B-Rezeptoren in zerebralen Blutgefäßen und Neuronen. Forschung
Das Prinzip der Signalübertragung von Hormonen mittels Rezeptoren und sekundärer Botenstoffe wurde 1960 erstmals postuliert, die Übertragung durch G-Proteine wurde in den 70er bis 80er Jahren des 20. Jahrhunderts erarbeitet. Für diese Arbeiten wurden 1971 Earl W. Sutherland Jr. „für seine Entdeckungen über die Wirkungsmechanismen von Hormonen“ und 1994 Alfred G. Gilman und Martin Rodbell „für die Entdeckung der Zellkommunikation und im speziellen der Entdeckung der G-Proteine“ mit dem Nobelpreis für Medizin geehrt.
G-Protein-gekoppelte Rezeptoren gehören nach wie vor zu den am intensivsten untersuchten Zielen für die Entwicklung neuer Medikamente in der Arzneimittelindustrie. Dabei rücken insbesondere neue, innerhalb der letzten 20 Jahre entdeckte Rezeptoren, wie beispielsweise Cannabinoid-Rezeptoren, CGRP-Rezeptoren, Chemokin-Rezeptoren, Endothelin-Rezeptoren, Leptin-Rezeptoren, Neurokinin-Rezeptoren und Neuropeptid-Y-Rezeptoren, in das Interesse der Forschung.
Literatur
Quellen
- ↑ Levoye A et al.: Do orphan G-protein-coupled receptors have ligand-independent functions? New insights from receptor heterodimers. EMBO Rep. 2006; 7(11):1094-1098. PMID 17077864
- ↑ Palczewski, K et al.: Crystal structure of rhodopsin: A G protein-coupled receptor. Science. 2000; 289:739-745. PMID 10926528
- ↑ Rasmussen SG et al.: Crystal structure of the human β2 adrenergic G-protein-coupled receptor. Nature. 2007 Nov 15;450(7168):383-7. Epub 2007 Oct 21. PMID 17952055
- ↑ Warne T et al.: Structure of a beta(1)-adrenergic G-protein-coupled receptor. Nature. 2008 Jun 25. Epub ahead of print. PMID 18594507
- ↑ Jaakola V et al.: The 2.6 Å Crystal Structure of a Human A2A Adenosine Receptor Bound to an Antagonist. Science Epub 2008 Oct 2. PMID 18832607
- ↑ http://www.pdb.org/pdb/explore/explore.do?structureId=3PBL
- ↑ Wu B, Chien EY, Mol CD, et al.: Structures of the CXCR4 Chemokine GPCR with Small-Molecule and Cyclic Peptide Antagonists. In: Science. Oktober 2010. doi:10.1126/science.1194396. PMID 20929726.
- ↑ Murakami M, Kouyama T: Crystal structure of squid rhodopsin. In: Nature. 453, Nr. 7193, Mai 2008, S. 363–367. doi:10.1038/nature06925. PMID 18480818.
- ↑ Tsunoda S., Sierralta J., Sun Y., Bodner R., Suzuki E., Becker A., Socolich M. & Zuker C.S. (1997). A multivalent PDZ-domain protein assembles signalling complexes in a G-protein-coupled cascade. Nature, 388, 243-249
- ↑ Nobles M., Benians A. & Tinker A. (2005). Heterotrimeric G proteins precouple with G protein-coupled receptors in living cells. Proc. Natl. Acad. Sci. USA, 120, 18706-18711.
- ↑ Patterson, C et al.: New Tricks of Old Dogs. Nonthrombotic Effects of Thrombin in Vessel Wall Biology. Circ. Res.. 2001; 88:987-997. PMID 11375267
- ↑ Tan C.M., Brady A.E., Nickols H.H., Wang Q. & Limbird L.E. (2004). Membrane trafficking of G protein-coupled receptors. Annu. Rev. Pharmacol. Toxicol., 44, 559-609.
- ↑ http://www.gpcr.org/7tm/
- ↑ Fredriksson R., Lagerstrom M.C., Lundin L.G. & Schiöth H.B. (2003). The G-protein-coupled receptors in the human genome form five main families. Phylogenetic analysis, paralogon groups, and fingerprints. Mol. Pharmacol., 63, 1256–1272. PMID 12761335
Weiterführende Literatur
- Ji T.H., Grossmann M. & Ji I. (1998). G protein-coupled receptors. I. Diversity of receptor-ligand interactions. J. Biol. Chem., 273, 17299–17302.
- Gether U. & Kobilka B.K. (1998). G protein-coupled receptors. II. Mechanism of agonist activation. J. Biol. Chem., 273, 17979–17982.
- Lefkowitz, R.J. (1998). G protein-coupled receptors. III. New roles for receptor kinases and beta-arrestins in receptor signaling and desensitization. J. Biol. Chem., 273, 18677–18680.
- Pierce K.L., Premont R.T., Lefkowitz R.J. (2002). Seven-transmembrane receptors. Nat. Rev. Mol. Cell. Biol. 9, 639-50
- Lefkowitz, R.J. & Whalen, E.J. (2004). Beta-arrestins: traffic cops of cell signaling. Curr. Opin. Cell Biol., 16, 162–168.
- Lefkowitz, R.J. & Shenoy, S.K. (2005). Transduction of receptor signals by beta-arrestins. Science 308, 512–517.
- Fredriksson R. & Schiöth H.B. (2005). The Repertoire of G-Protein–Coupled Receptors in Fully Sequenced Genomes. Mol. Pharmacol., 67, 1414–1425.
- Hill S.J. (2006). G-protein-coupled receptors: past, present and future. Br. J. Pharmacol., 147, S27-S37.
- Lodish, Berk, Zipursky, Matsudaira: „Molekulare Zellbiologie“ 4. Auflage S. 922ff.
- Alberts et al.: "Molecular Biology of the Cell", 4th ed., S. 852ff.
Weblinks
- Klassifizierung der G-Protein-gekoppelten Rezeptoren (englisch)
- IUPHAR Receptor Database – ausführliche Liste GPCR-artiger Rezeptoren der International Union of Pharmacology (englisch)
- Modern Drug Discovery - It’s a GPCR world (englisch)

Dieser Artikel wurde am 20. Mai 2006 in dieser Version in die Liste der exzellenten Artikel aufgenommen. Kategorien:- Wikipedia:Exzellent
- Neurobiologie
- G-Protein-gekoppelter Rezeptor
- Proteingruppe
Wikimedia Foundation.